Coordinación de Universidad Abierta, Innovación Educativa y Educación a Distancia de la UNAM. ©Todos los derechos reservados 2021. Hecho en México. Este sitio puede ser reproducido con fines no lucrativos, siempre y cuando no se mutile, se cite la fuente completa y su dirección electrónica, de otra forma, se requiere permiso previo por escrito de la Institución.
Al navegar en este sitio, encontrará contenidos diseñados por académicos de la UNAM, denominados Recursos Educativos Abiertos (REA), disponibles para todo el público en forma gratuita. Los contenidos de cada REA son responsabilidad exclusiva de sus autores, y de las entidades académicas a las que están adscritos quienes los desarrollan. Asimismo, los REA no tienen impedimento en materia de propiedad intelectual; ni contienen información que por su naturaleza pueda considerarse confidencial y reservada.
Los REA podrán ser utilizados sin fines de lucro, citando invariablemente la fuente y sin alterar la obra, respetando los términos institucionales de uso y los derechos de propiedad intelectual de terceros. Si desea más información, escriba a proyectos@cuaed.unam.mx

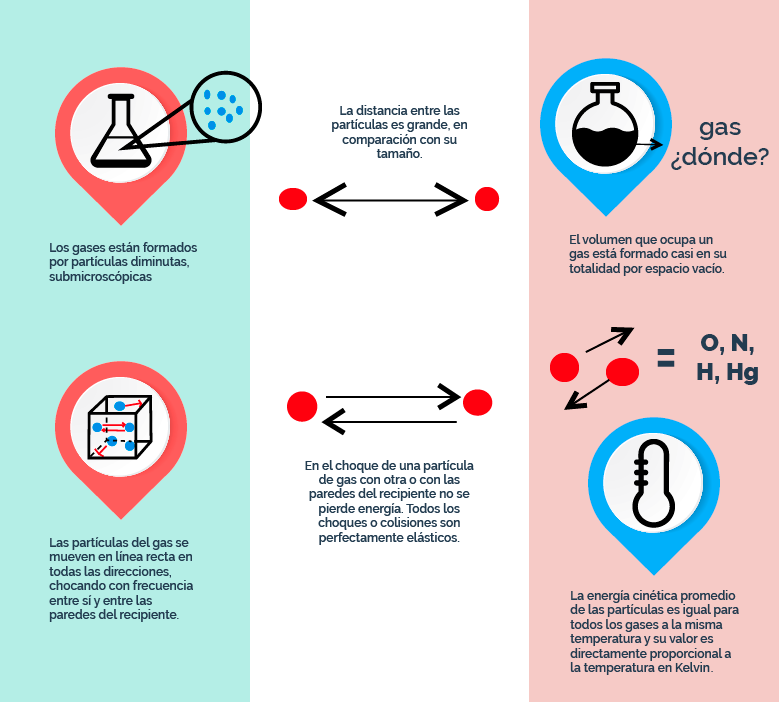
Ley general de estado gaseoso: ecuación de los gases ideales por Israel Valencia Quiroz se distribuye bajo una Licencia Creative Commons Atribución-NoComercial-SinDerivadas 4.0 Internacional.