Introducción
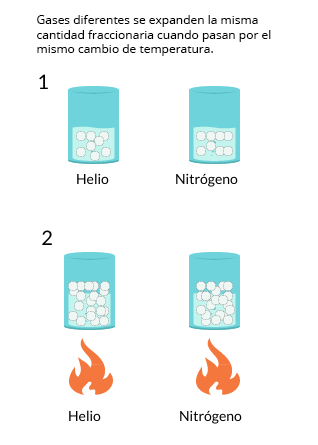
Las leyes empíricas se vinculan con las matemáticas, que describen las relaciones entre las variables de estado —presión, volumen, temperatura— en los gases; se denominan empíricas, debido a que son el resultado de observaciones y numerosos experimentos sobre distintos sistemas gaseosos.
En esta unidad, cuya duración es de una hora, revisarás una de éstas, la ley de Charles, desde sus elementos
generales hasta el proceso que se sigue cuando se aplica a un problema de impacto biológico. Un ejemplo es
cuando se sumergen globos en nitrógeno líquido y el gas al interior disminuye su volumen, lo que los
comprime.

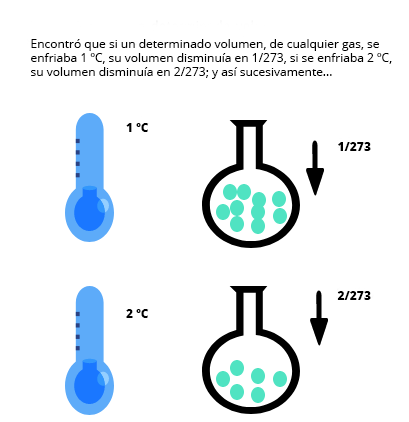
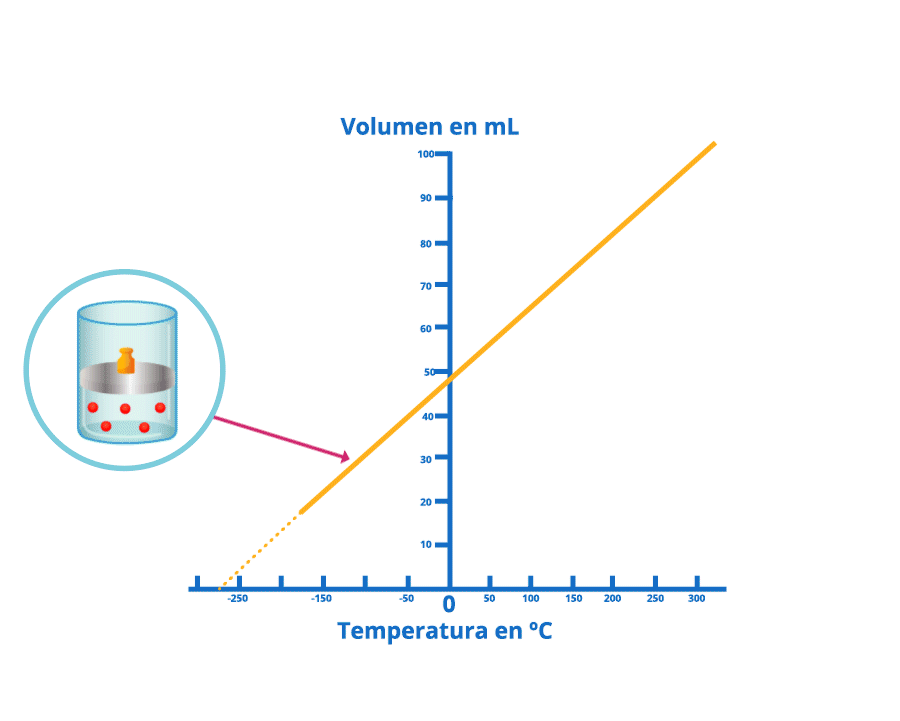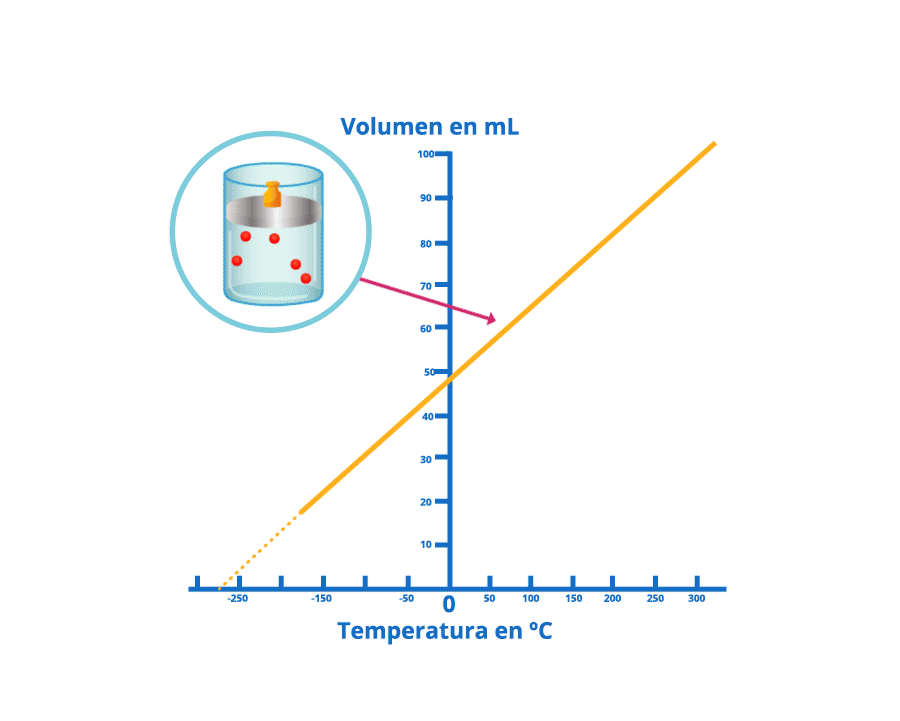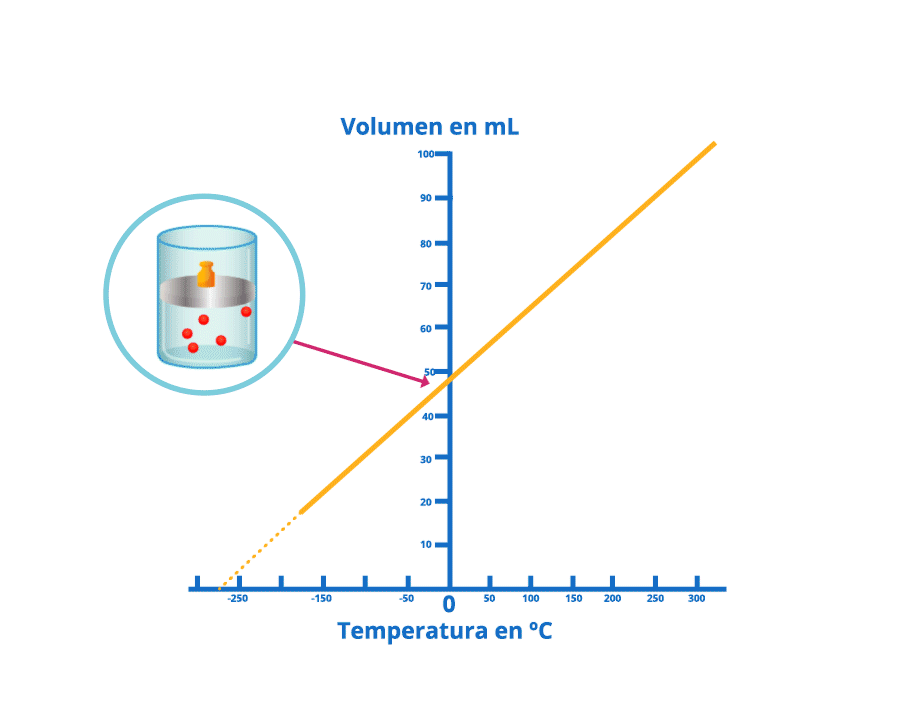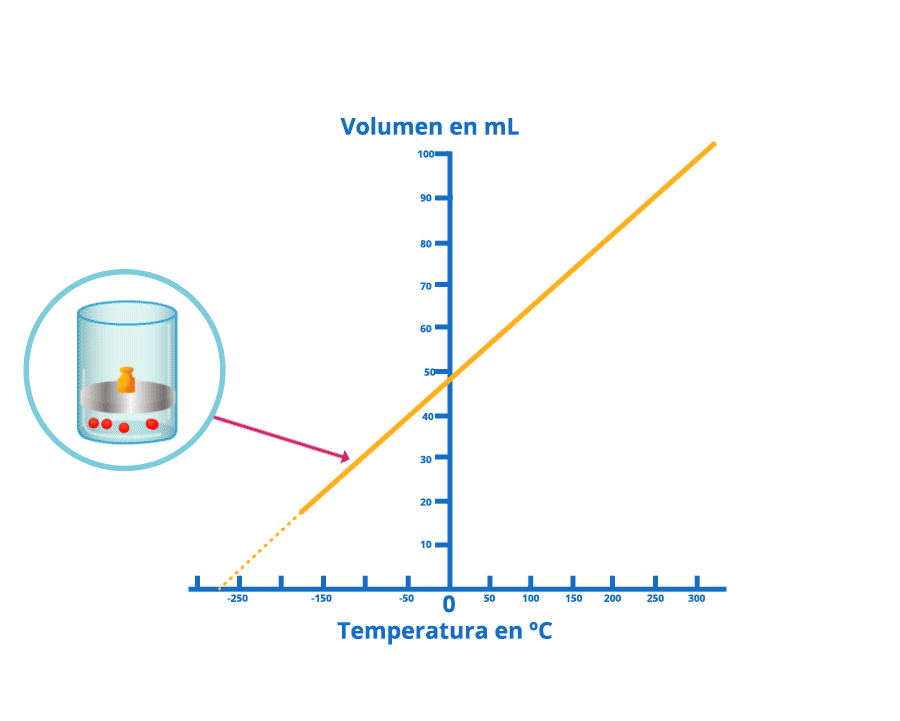
Disminución del volumen bajo la ley de Charles