En esta unidad, vamos a revisar la síntesis de la molécula de glucosa de novo (gluconeogénesis), ubicando el compartimento celular donde se lleva a cabo.
Primero, te presentaremos a los precursores y el origen de cada uno de ellos; después, las enzimas que regulan esta vía, mencionando aquellas que comparten con la vía de la glucólisis y enfatizando las enzimas propias de su regulación. También estudiarás la relación existente entre los diferentes tejidos del cuerpo en un estado de inanición y de ejercicio prolongado o en su ejecución intensa.
Es importante que aprendas la relevancia de los pasos que se llevan a cabo para la formación de glucosa, en momentos en que el organismo carece de carbohidratos; esto nos lleva a entender la relación que existe entre diferentes tejidos, compartimentos celulares y moléculas orgánicas que intervienen en su formación.
Se sugiere que, para conocer mejor esta vía, revises con antelación la vía de la y se dé un breve repaso a la de la . La primera es importante, pues varias de las enzimas de esta vía se comparten con la ruta metabólica, que es tema de nuestro estudio; por su parte, la glucogenólisis se sugiere, ya que es otra vía que comparte el mismo objetivo de la gluconeogénesis, que es proveer de glucosa al organismo en momentos definidos.
Es importante mencionar que la corteza renal puede llevar a cabo el proceso de la gluconeogénesis, aunque la mayor parte de la glucosa producida por ésta es utilizada por la médula renal. Por tal motivo, nos enfocaremos en la gluconeogénesis, que se lleva a cabo principalmente en el hígado, sintetizando glucosa a partir de moléculas distintas a los carbohidratos.
 |
Debes saber que… |
Las tres fuentes principales de carbono o precursores para la gluconeogénesis en el organismo son:
1. Lactato: ácido orgánico débil que se encuentra en los músculos, sangre y algunos órganos.
2. Aminoácidos: conjunto de 20 tipos distintos de moléculas que constituyen las piezas básicas para construir proteínas.
3. Glicerol: alcohol con tres grupos hidroxilos, producto de la degradación digestiva de los lípidos.
Una vez que el cuerpo ha agotado su reserva de glucosa, es cuando comienzan a intervenir estos precursores para sintetizar la nueva molécula.
La gluconeogénesis comprende 11 reacciones desde el piruvato hasta la glucosa; siete de ellas están catalizadas por enzimas que comparte con la vía de la glucólisis (reversibles) y cuatro reacciones las llevan a cabo enzimas propias de esta vía (irreversibles), de las cuales tres son citosólicas (fosfoenolpiruvato carboxicinasa, fructosa-1,6-bifosfatasa y glucosa-6-fosfato fosfatasa) y una mitocondrial (piruvato-carboxilasa), como se puede ver en el esquema “Vía de la gluconeogénesis”.
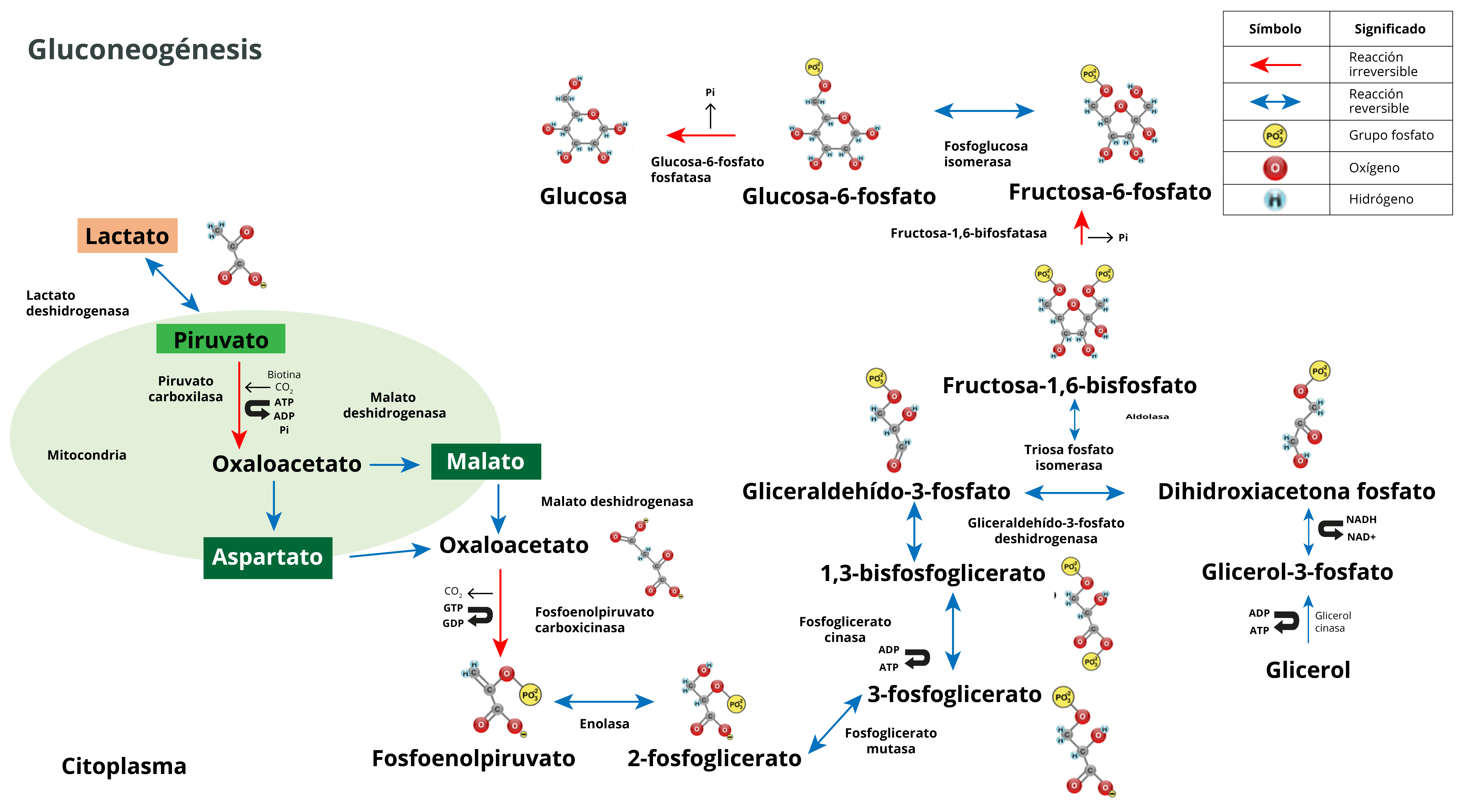
Vía de la gluconeogénesis
Una vez obtenido el piruvato (a partir de lactato, alanina y otros aminoácidos), éste ingresa a la mitocondria, donde es carboxilado por la enzima piruvato carboxilasa, la cual requiere biotina, como coenzima, y . El producto de esta reacción es oxaloacetato, que no puede cruzar la membrana mitocondrial interna; por lo tanto, es convertido en malato o aspartato, que sí pueden hacerlo, y se reconvierte a oxaloacetato en el citosol. El oxaloacetato es descarboxilado y se forma fosfoenolpiruvato por acción de la enzima fosfoenolpiruvato carboxicinasa. Esta reacción requiere (ver diagrama “Conversión de piruvato en fosfoenolpiruvato”).
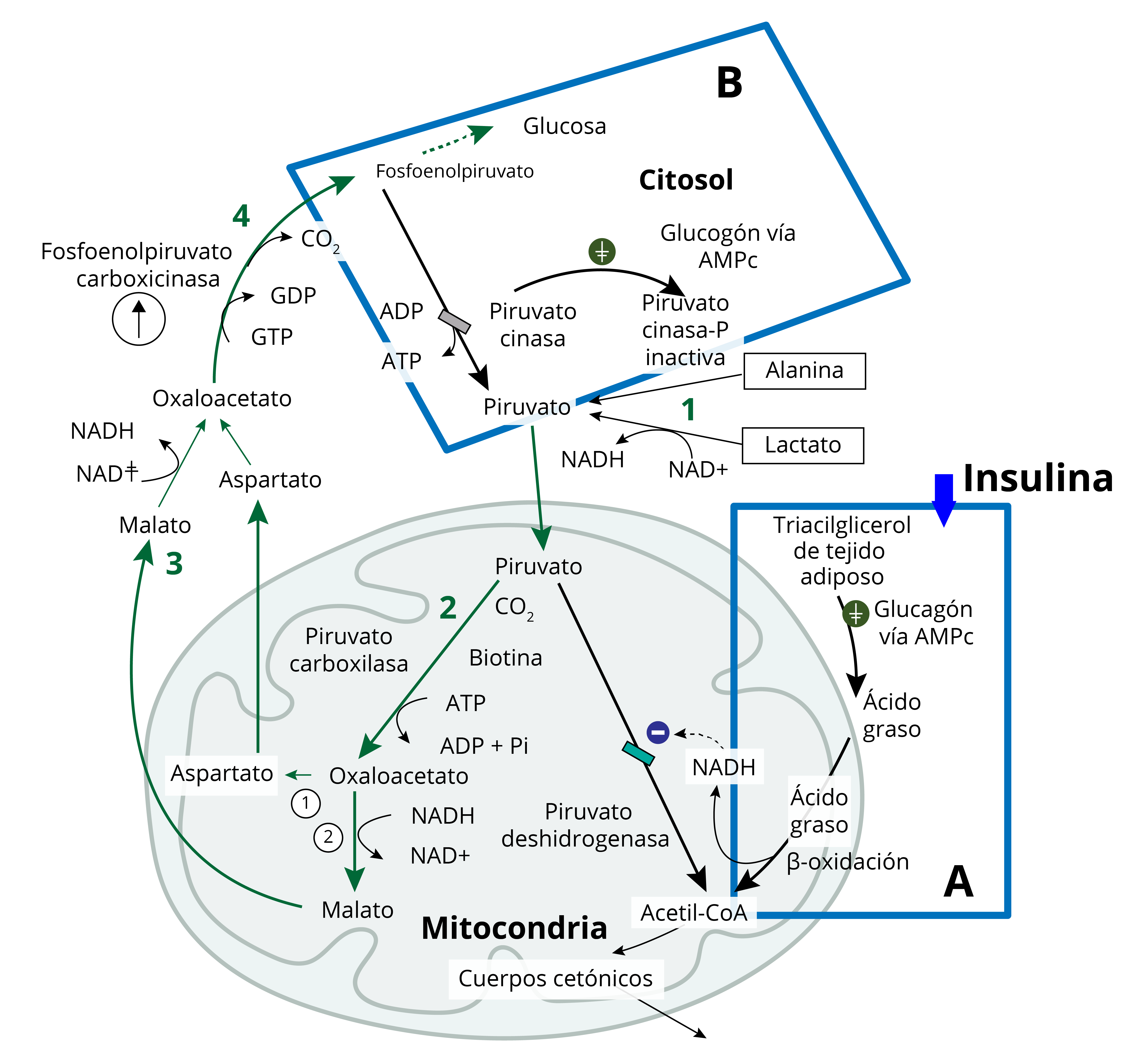
(s. a.) (2015). Conversión de piruvato en fosfoenolpiruvato [diagrama].
Elaboración propia, con base en Lieberman, M. A. y Ricer, R. (2015). Bioquímica, biología molecular y genética, p. 206.
Los pasos siguientes corresponden a las reacciones reversibles de la glucólisis, desde fosfoenolpiruvato hasta llegar a fructosa 1,6-bisfosfato (ver diagrama “Vía de la gluconeogénesis”).
La enzima fructosa 1,6-bisfosfatasa cataliza la eliminación del fosfato del carbono 1 de la fructosa-1,6-bisfosfato, con lo que se obtiene como producto fructosa 6-fosfato. La fructosa 6-fosfato se convierte en glucosa-6-fosfato por la misma isomerasa usada en la glucólisis.
La glucosa-6-fosfato libera fosfato inorgánico; la enzima glucosa-6-fosfato fosfatasa cataliza la reacción, obteniendo como producto glucosa libre, la cual puede ingresar al torrente sanguíneo. Esta enzima interviene tanto en la gluconeogénesis como en la glucogenólisis.
Gluconeogénesis
En condiciones de ayuno, la hormona glucagón se eleva y estimula que se lleve a cabo la vía de la gluconeogénesis. Los pasos que se llevan a cabo para inducir esta vía son los siguientes:
1. La disminución de insulina e incremento de glucagón estimulan la liberación de ácidos grasos a partir de tejido adiposo. Los ácidos grasos viajan al hígado y se oxidan, produciendo acetil-CoA, NADH y ATP (ver diagrama “Conversión de piruvato en fosfoenolpiruvato”, cuadro A).
2. La enzima piruvato deshidrogenasa se inactiva por el y por el acetil-CoA generado en la β-oxidación. Por consiguiente, el piruvato generado no se convierte en acetil-CoA, sino en oxaloacetato.
3. Piruvato-carboxilasa: las altas concentraciones de acetil-CoA generado en la β-oxidación (dentro de la mitocondria) activan la enzima piruvato carboxilasa; debe señalarse que la piruvato-carboxilasa se activa tanto en el estado posprandial como en el de ayuno.
4. La enzima fosfoenolpiruvato carboxicinasa es reprimida por la insulina y es inducible por el que se produce por la estimulación de glucagón. El AMPc activa la proteína cinasa A, la cual fosforila un conjunto de factores de transcripción que estimulan la transcripción del gen del fosfoenolpiruvato carboxicinasa. El cortisol, un glucocorticoide, también induce la transcripción del gen de esta enzima, pero a través de un sitio regulador en el promotor del gen.
5. Piruvato cinasa: el fosfoenolpiruvato producido no se transforma nuevamente en piruvato porque la proteína cinasa A fosforila la piruvato-cinasa y de esa manera se inactiva (ver diagrama “Conversión de piruvato en fosfoenolpiruvato”, cuadro B). Al estar la piruvato-cinasa relativamente inactivo, el fosfoenolpiruvato, en una serie de pasos, forma fructosa-1,6-bisfosfato.
6. Cuando las concentraciones de AMP y fructosa-2,6-bisfosfato son bajas y la de su inhibidor ATP es relativamente alta, la enzima fosfofructocinasa-1 es casi inactiva y la fructosa-1,6-bisfosfatasa es más activa. Durante el ayuno, se induce la transcripción del gen de la fructosa-1,6-bisfosfatasa.
7. La glucocinasa es relativamente inactiva porque tiene un valor de Km alto para la glucosa; en condiciones que favorecen la gluconeogénesis, la concentración de glucosa es baja. Por lo tanto, la glucosa libre no se reconvierte en glucosa-6-fosfato.
Es importante que identifiques las hormonas que intervienen en la regulación de esta vía.
A partir de piruvato, se gasta un ATP en la carboxilación de aquél; asimismo, se consume un GTP (equivalente de un ATP) en la conversión de oxaloacetato a fosfoenolpiruvato y un ATP más en la conversión de 3-fosfoglicerato a 1,3-bisfosfoglicerato. Debido a que se requieren dos moléculas de piruvato para originar una molécula de glucosa, la estequiometría de la gluconeogénesis a partir de piruvato acopla la escisión de seis moles de ATP y la oxidación de dos de NADH. La energía que se necesita se obtiene de la β-oxidación de los ácidos grasos. Si escribimos la reacción para resumir este gasto de energía, tenemos:
2 moleculas de piruvato+4 ATP+2 GTP+2 NADH+2 H→glucosa+4 ADP+2 GDP+6 +2 NAD
A partir de glicerol, esta molécula entra a la vía de la gluconeogénesis al nivel de la dihidroxiacetona fosfato (ver diagrama “Gluconeogénesis”). La conversión del glicerol en glicerol-3-fosfato, que se oxida a dihidroxiacetona fosfato, requiere un ATP. Ya que se requieren dos moléculas de glicerol para formar una de glucosa, se necesitan dos moles de ATP para la síntesis de un mol de glucosa.
Es vital la presencia de glucosa en sangre y sumamente importante la concentración de esta molécula en el torrente sanguíneo, en especial cuando excede de lo normal (hiperglucemia) o su concentración es muy baja (hipoglucemia). Este tema es referido en la literatura como control de la glucemia.
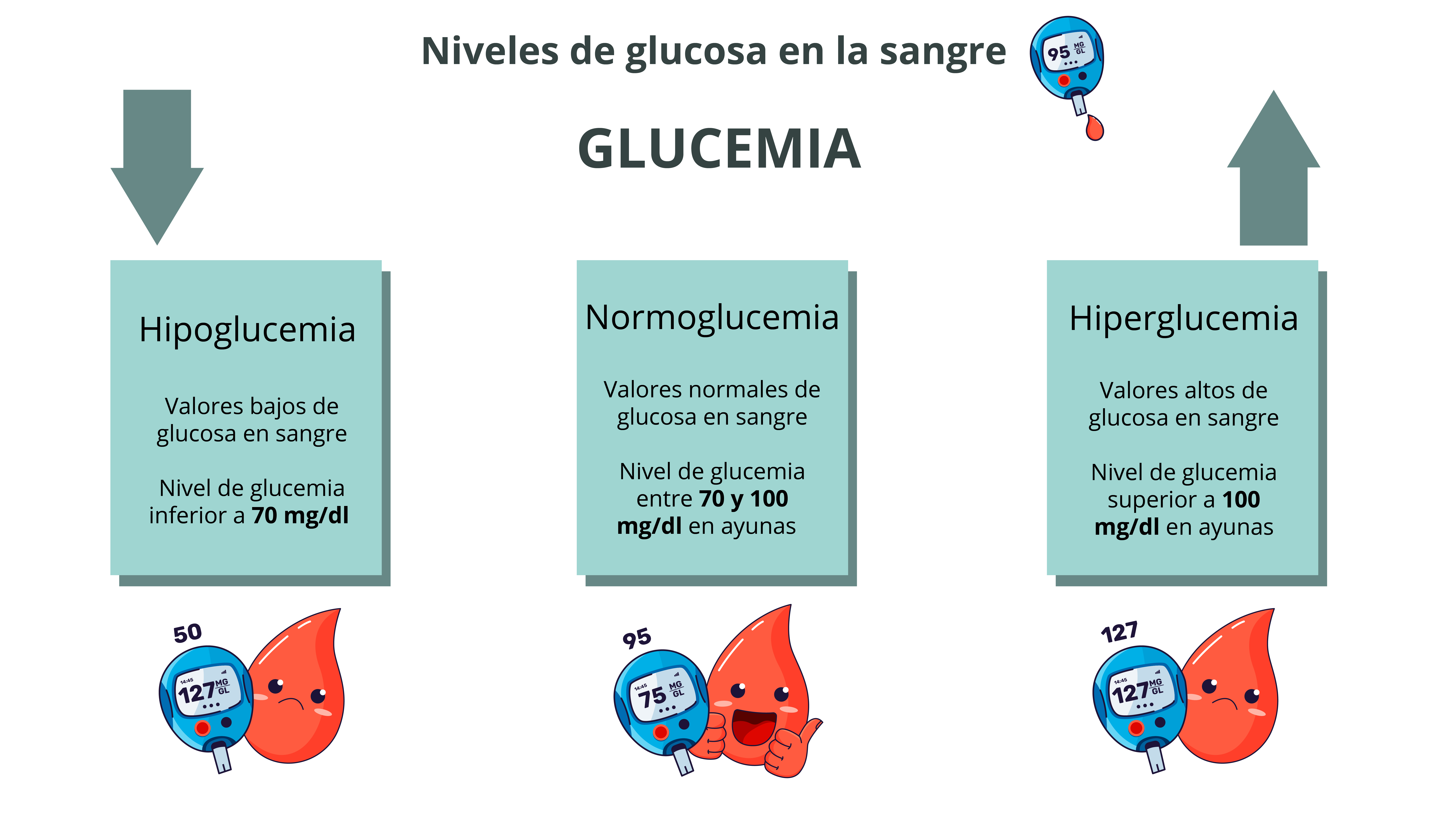
Niveles de glucosa en la sangre
La concentración de glucosa en nuestro organismo se mantiene dentro de un intervalo estrecho, resultado del equilibrio en los alimentos que come periódicamente un individuo sano en el día y el ayuno que lleva entre comidas y por la noche.
Aun en ocasiones en las que el individuo no coma por periodos largos o en actividades extenuantes, los niveles de glucosa disminuyen lentamente.
Las principales hormonas que regulan la glucemia son la insulina y el glucagón. Después de ingerir una comida, la glucosa sanguínea es aportada por carbohidratos de los alimentos.
Durante el ayuno, el hígado mantiene la glucemia por los procesos de glucogenólisis y gluconeogénesis. En las primeras horas de ayuno, la glucogenólisis es la vía responsable de mantener la glucemia. Conforme el ayuno avanza y las reservas de glucógeno disminuyen, la gluconeogénesis es la vía de aporte adicional de glucosa en la sangre. Después de 30 a 48 horas, el glucógeno se agota y la gluconeogénesis pasa a ser la principal fuente de glucosa sanguínea. En la inanición (ayuno prolongado), el músculo reduce su empleo de cuerpos cetónicos. Como resultado, la concentración sanguínea de éstos aumenta y el encéfalo los utiliza como fuente de energía; así, el encéfalo necesita menos glucosa y la gluconeogénesis se desacelera, lo cual ahorra proteína muscular. Esto ocurre después de alrededor de tres o cuatro días de inanición.
Estos cambios en los patrones de empleo del combustible de diversos tejidos hacen posible la supervivencia por periodos prolongados sin alimento.
Ayuno prolongado (inanición)
Cuando el organismo entra en estado de inanición, a los tres o cinco días de ayuno, ocurren modificaciones metabólicas en el organismo; es decir, hay cambios en el uso de las reservas de combustible como se puede ver en el diagrama “Estado de inanición”.
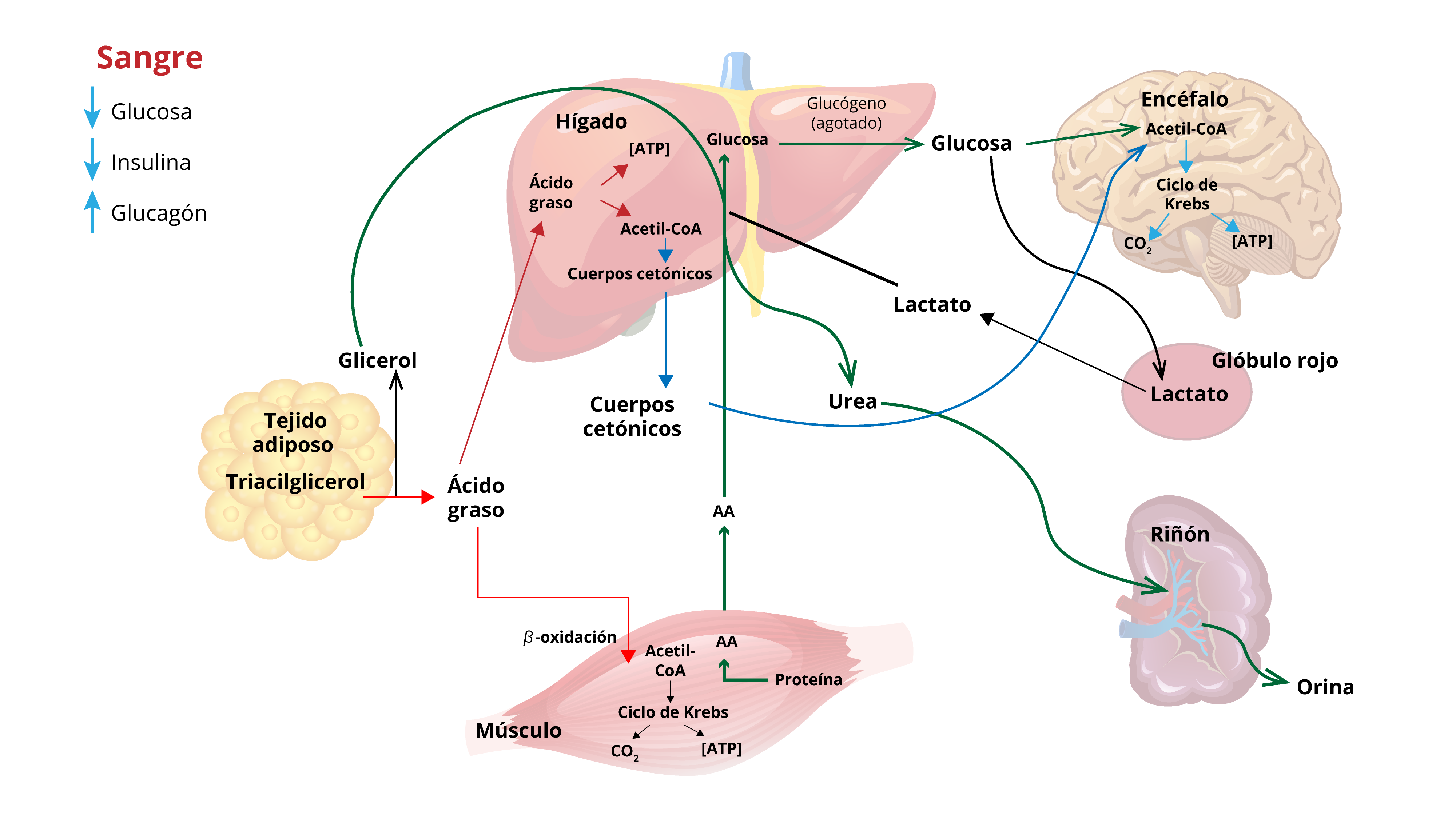
(s. a.) (2015). Estado de inanición [diagrama]. Elaboración propia,
con base en Lieberman, M. A. y Ricer, R. (2015). Bioquímica, biología molecular y genética, p. 206.
1. El músculo reduce el uso de cuerpos cetónicos y oxida ácidos grasos como su principal fuente de energía. Al no utilizar los cuerpos cetónicos, la concentración de estas moléculas aumenta en la sangre en este órgano. Entonces, el encéfalo capta y oxida los cuerpos cetónicos para obtener energía (líneas en azul, véase diagrama “Estado de inanición”). Por consiguiente, dicho órgano disminuye su uso de glucosa.
2. Cabe enfatizar que la molécula de glucosa siempre es un combustible importante para el encéfalo.
3. La gluconeogénesis realizada en el hígado disminuye.
4. Se degrada menos proteína muscular a fin de generar aminoácidos para la formación de nueva glucosa (líneas verdes). Al haber menor conversión de aminoácidos en glucosa, se produce menos urea a partir del nitrógeno de los aminoácidos en la inanición que sucede en el ayuno de una noche (líneas verdes).
5. La proteína muscular se conserva y el organismo usa sus reservas de grasa como fuente principal de energía durante la inanición (líneas en rojo, ver diagrama “Estado de inanición”). El tiempo que una persona puede sobrevivir sin alimento depende en mayor medida de la cantidad de grasa almacenada en el tejido adiposo.
Durante el ejercicio, intervienen mecanismos similares a aquellos que se usan durante el ayuno, con el propósito de mantener los niveles de glucosa en sangre. El hígado mantiene la glucemia a través de la glucogenólisis y la gluconeogénesis inducidas por las hormonas glucagón y epinefrina; sin embargo, cuando realizamos ejercicio de alta intensidad, acontecen los cambios que narraremos adelante:
1. La cadena de transporte de electrones, el ciclo de los ácidos tricarboxílicos y la β-oxidación se activan por el aumento de ADP y disminución de ATP.
2. La enzima piruvato deshidrogenasa se mantiene activa y no fosforilada, siempre y cuando el NADH pueda reoxidarse en la cadena de transporte de electrones y la acetil-CoA pueda entrar al ciclo de los ácidos tricarboxílicos.
3. Aunque el metabolismo mitocondrial trabaje a su máxima capacidad, puede necesitarse ATP adicional durante ejercicios extenuantes y de alta densidad. Cuando esto ocurre, el ATP no se produce con suficiente rapidez para alcanzar las necesidades musculares y el AMP se empieza a acumular.
4. Las cantidades elevadas de AMP activan la fosfofructocinasa-1 y la glucogenólisis, suministrando, de esta manera, ATP adicional proveniente de la glucólisis anaeróbica (el piruvato adicional producido no entra en la mitocondria, sino que se convierte en lactato para que la glucólisis pueda continuar). En estas condiciones, la mayor parte del piruvato formado por la glucólisis entra al ciclo de los ácidos tricarboxílicos, mientras que el remanente se reduce a lactato para regenerar NAD+, este último necesario para que la glucólisis continúe funcionando.
5. El lactato liberado del músculo esquelético durante el ejercicio puede ser utilizado por éste en reposo o por el corazón (músculo con alta cantidad de mitocondrias y capacidad oxidativa). En ambos músculos, la relación NADH/NAD+ es más baja que en el músculo esquelético en ejercicio y la reacción de la lactato-deshidrogenasa procede en la dirección de formación del piruvato. El piruvato generado se convierte, entonces, en acetil-CoA y se oxida en el ciclo de los ácidos tricarboxílicos, hasta producir energía por la fosforilación oxidativa.
6. El segundo destino del lactato es el regreso al hígado a través del ciclo de Cori, en el cual se convierte en glucosa (ver diagrama “Ciclo de Cori”).

Ciclo de Cori
Es conveniente comentar que el ejercicio de intensidad baja a moderada puede llevarse a cabo por periodos más largos que los de alta intensidad. Esto se debe a que la oxidación aeróbica de glucosa y ácidos grasos generan más energía por molécula de combustible que sólo el metabolismo anaeróbico y a que también este tipo de ejercicio produce ácido láctico a una tasa menor respecto del metabolismo anaeróbico. Por lo tanto, durante el ejercicio de baja a moderada intensidad, la liberación del lactato muscular disminuye a medida que el metabolismo aeróbico de la glucosa y ácidos grasos se vuelve predominante.
● El proceso de producción de glucosa a partir de moléculas que no sean hidratos de carbono se denomina gluconeogénesis, la cual ocurre fundamentalmente en el hígado.
● Los precursores principales para la producción de glucosa son lactato, glicerol y aminoácidos.
● Esta vía comparte las reacciones reversibles de la glucólisis, además, de utilizar reacciones para circundar los pasos irreversibles. Las enzimas que llevan a cabo estas reacciones son piruvato-carboxilasa, fosfoenolpiruvato carboxicinasa, fructosa-1,6-bisfosfatasa y glucosa-6-fosfato fosfatasa.
● Las vías de gluconeogénesis y glucogenólisis son reguladas minuciosamente, debido a lo cual las concentraciones de glucosa sanguínea se pueden mantener a nivel constante durante el ayuno. La regulación del metabolismo de los triacilgliceroles está coordinada con la regulación de los niveles de la glucosa sanguínea.
● Después del ayuno por tres días, el hígado libera cuerpos cetónicos (derivados de la oxidación de la grasa) como un suministro alternativo de combustible para el cerebro. Las reservas de glucógeno se agotan y la gluconeogénesis proporciona la glucosa al cuerpo.
● En la inanición prolongada, el cerebro se puede adaptar para usar cuerpos cetónicos como energía, lo que disminuye la demanda de glucosa. Esto reduce el ritmo de degradación de la proteína muscular para proporcionar los precursores para la gluconeogénesis y hace posibles tiempos de sobrevivencia más extendidos bajo condiciones de inanición.
● En condiciones anaeróbicas, el piruvato es reducido a lactato por el NADH, con lo cual se regenera el NAD+ necesario para que la glucólisis continúe.
● El lactato liberado de las células que realizan la glucólisis anaeróbica es captado por otros tejidos, sobre todo, hígado, corazón, y músculo esquelético, y oxidado de nuevo a piruvato. En el hígado, el piruvato se usa para sintetizar glucosa (gluconeogénesis), la cual es devuelta a la sangre. La recirculación de lactato y glucosa entre tejidos periféricos e hígado se denomina ciclo de Cori.
Se deben identificar las enzimas que participan en la vía de la gluconeogénesis, ya que es importante el conocimiento de éstas, pues son las responsables de controlar el buen funcionamiento de la vía, a diferencia de las hormonas, que son quienes inducen los pasos que se siguen en ella.
Hemos revisado que el proceso de síntesis de novo de glucosa implica varios pasos que dependen de los requerimientos de energía durante los ciclos ayuno/alimentación, reconociendo la gluconeogénesis hepática como la vía metabólica principal que mantiene los niveles de glucosa normales en sangre, durante períodos prolongados de ayuno.
Fuentes de información
Básicas
Ferrier, D. (2017). Bioquímica (7ª. ed.). Barcelona: Wolters Kluwer.
Lieberman, M. A. y Peet, A. (2018). Marks. Bioquímica médica básica: un enfoque clínico (5.a ed.). Barcelona: Wolters Kluwer.
Lieberman, M. A. y Ricer, R. (2015). Bioquímica, biología molecular y genética (6.a ed.). Barcelona: Wolters Kluwer.
Complementaria
Baynes, J. W. y Dominiczak, M. H. (2015). Bioquímica médica (4.a ed.). Barcelona: Elsevier.
Cómo citar
Meraz, N., Perea, V. G. y González, M. (2022). Gluconeogénesis. Unidades de Apoyo para el Aprendizaje. CUAIEED/Facultad de Medicina UNAM. (Vínculo)