Las proteínas son macromoléculas esenciales para el funcionamiento biológico y poseen una enorme variedad de tamaños y funciones. Los aminoácidos son las subunidades que forman estas proteínas. Las proteínas se forman mediante la unión covalente de múltiples aminoácidos. Puede imaginarse a los aminoácidos como piezas de construcción con propiedades específicas, los cuales, dispuestos de distintas formas, son capaces de crear desde pequeñas casas hasta castillos enteros.
Aminoácidos formando una proteína
Todas las proteínas están compuestas de 20 aminoácidos. Cada aminoácido se abrevia con tres letras. En esta unidad, revisaremos las características generales de los aminoácidos
Todos los aminoácidos tienen un átomo de carbono alfa (α) unido a:
Su composición se muestra en la siguiente figura:
La estructura general de los aminoácidos consiste en un carbono α alrededor del cual se encuentra un grupo amino (NH3+), un grupo carboxilo (COO-), un átomo de hidrógeno y una cadena lateral (R). El carbono α forma cuatro enlaces con moléculas diferentes; por esta razón, se dice que los aminoácidos son asimétricos.
La cadena lateral de los aminoácidos es la que les da sus propiedades características, así como variaciones de tamaño, solubilidad y carga eléctrica. Los átomos de carbono presentes en la cadena lateral se denominan β, γ, δ, ε, etcétera.
Glicina
Se observa que la glicina posee dos átomos de hidrógeno; por lo tanto, ya no se considera un aminoácido asimétrico porque los cuatro sustituyentes con los que forma enlaces el carbono α no son diferentes; asimismo, la glicina se considera el aminoácido con menor impedimento estereoquímico; es decir, es el aminoácido más pequeño porque su cadena lateral (R) es sólo un átomo de hidrógeno.
Por otra parte, los aminoácidos se denominan L-aminoácido o D-aminoácido dependiendo de la posición del grupo amino; si se encuentra a la derecha, se denomina D-aminoácido; si se localiza a la izquierda, se denomina L-aminoácido (véase la siguiente figura). A estas dos “versiones” de aminoácidos se les conoce con el nombre de enantiómeros o isómeros ópticos. Estas moléculas son imágenes en espejo.
En los seres biológicos, los aminoácidos son casi exclusivamente L-aminoácidos. En el caso del humano, sólo utiliza L-aminoácidos en su metabolismo. Esto tiene implicaciones importantes, ya que, para que se dé la interacción adecuada de aminoácidos y la formación estable de proteínas, es necesario que los aminoácidos sean del mismo tipo estereoquímico.
Los aminoácidos se clasifican dependiendo de las características químicas que les confiere su cadena lateral; a continuación, revisaremos cada uno de éstos:
Los aminoácidos que se clasifican como no polares son alanina, valina, leucina, isoleucina, metionina, triptófano y fenilalanina (véase la siguiente figura). Los primeros cinco poseen en su cadena lateral átomos de hidrógeno y carbono, lo que les confiere esta naturaleza de no polares. El triptófano y la fenilalanina, por otra parte, poseen grupos aromáticos que les confieren la naturaleza de no polar. Es importante mencionar que la metionina también se puede clasificar, junto con la cisteína, como aminoácidos que tienen azufre.
Aminoácidos no polares
Estos aminoácidos poseen un grupo amino en su cadena lateral. El pKa del grupo amino es 9.5, por lo que a pH fisiológico está cargado positivamente. Los tres aminoácidos clasificados aquí son lisina, arginina e histidina (véase la siguiente figura). La histidina se ioniza a pH fisiológico, por lo que también está involucrada en reacciones enzimáticas y puede funcionar como amortiguador.
Aminoácidos con carga positiva
Estos aminoácidos poseen en su cadena lateral un grupo carboxilo, el cual a pH fisiológico se disocia quedando con carga negativa. Estos aminoácidos son el aspartato y el glutamato, como se muestra en la siguiente figura:
Aminoácidos con carga negativa
Seis aminoácidos conforman este grupo. Todos contienen cadenas laterales que forman puentes de hidrógeno con el agua; por lo tanto, son polares. Los principales grupos funcionales involucrados en la polaridad de estos aminoácidos son grupos hidroxilo presentes en la serina, la treonina y la tirosina, el grupo tiol presente en la cisteína y grupos amida en la asparagina y la glutamina (véase la siguiente figura). Estos dos últimos se forman a partir de aspartato y glutamato, respectivamente. Finalmente, la cisteína es, junto con la metionina, uno de los dos aminoácidos con azufre. La cisteína tiene un grupo tiol que forma enlaces disulfuro con otras moléculas de cisteína, lo cual tiene implicaciones estructurales importantes en la conformación de las proteínas.
Aminoácidos polares sin carga
* El -OH de la tirosina participa en la formación de puentes de hidrógeno; por esa razón, se puede clasificar como aminoácido polar sin carga; sin embargo, también se puede clasificar como aminoácido aromático.
** La cisteína también se puede clasificar como aminoácido que contiene azufre.
La principal clasificación es la anterior; sin embargo, en ocasiones también se hace la siguiente:
Tres aminoácidos conforman este grupo. La fenilalanina, la tirosina y el triptófano presentan anillos aromáticos formados por seis átomos de carbono con una gran estabilidad (ver la siguiente figura). El triptófano tiene un grupo indol con un anillo de seis carbonos unido a otro anillo de cinco componentes. La tirosina, por su parte, tiene un grupo aromático y otro hidroxilo, que conforman en conjunto un grupo fenol, el cual puede verse involucrado en reacciones enzimáticas. El triptófano y la tirosina absorben luz ultravioleta. La fenilalanina lo hace de igual forma, pero en menor cantidad.
Aminoácidos aromáticos
Dentro de este grupo, como ya se mencionó anteriormente, se encuentran la metionina y la cisteína, como se puede ver en la siguiente imagen:
Aminoácidos con azufre
La clasificación de la glicina y la prolina varía mucho dependiendo de cada autor, debido a sus características de las cadenas laterales.
En la siguiente tabla, se muestra la clasificación de los aminoácidos junto con su abreviación y su símbolo.
Cada aminoácido recibe un nombre abreviado de tres letras y un símbolo de una para poderlos identificar de manera rápida. La escritura de una sola letra es útil cuando se desea saber la secuencia de aminoácidos de una proteína.
| Clasificación | Aminoácido | Abreviación | Símbolo |
|---|---|---|---|
| No polares |
Alanina Valina Leucina Isoleucina Metionina Glicina |
Ala Val Leu Ile Met Gly |
A V L I M G |
| Aromáticos |
Fenilalanina Tirosina Triptófano |
Phe Tyr Trp |
F Y W |
| Polares sin carga |
Serina Treonina Cisteína Asparagina Glutamina Prolina |
Ser Thr Cys Asn Gln Pro |
S T C N Q P |
| Con carga positiva |
Lisina Histidina Arginina |
Lys His Arg |
K H R |
| Con carga negativa |
Aspartato Glutamato |
Asp Glu |
D E |
Clasificación de los aminoácidos
Con anterioridad, revisamos la clasificación química de los aminoácidos; sin embargo, éstos también pueden ordenarse desde el punto de vista nutricional en aminoácidos esenciales y no esenciales.
El cuerpo humano puede producir 11 del total de 20 aminoácidos necesarios. Los nueve restantes deben ser ingeridos. Por esta razón, aquellos aminoácidos que no pueden ser sintetizados se denominan esenciales, como se puede ver en la siguiente tabla:
| Esenciales | No esenciales |
|
Fenilalanina Histidina Isoleucina Leucina Lisina Metionina Treonina Triptófano Valina |
Alanina Arginina Asparagina Aspartato Cisteína Glicina Glutamato Glutamina Prolina Serina Tirosina |
Los aminoácidos esenciales son aquellos que el cuerpo humano no puede sintetizar, por lo que es necesario obtenerlos de la dieta
Una vez que revisaste la clasificación química de los aminoácidos, te presentamos esta actividad que tiene como objetivo reforzar tus conocimientos adquiridos. En ella, tienes que arrastrar los aminoácidos a la clasificación que corresponda.
Los aminoácidos pueden actuar como ácidos o bases; es decir, son moléculas anfóteras. Esto se debe a que tanto el grupo alfa-carboxilo y alfa-amino son ionizables. Por lo tanto, las curvas de disociación de los aminoácidos presentan dos valores de pKa, uno para el grupo alfa-carboxílico y otro para el alfa-amino. En algunos casos, las cadenas laterales también pueden ionizarse, por lo cual hay aminoácidos con tres valores de pKa.
En la mayoría de los aminoácidos, los valores de pKa para el alfa-ácido carboxilo se encuentran en un pH de ~2 y aquellos del grupo alfa-amino se encuentran en un pH de ~9.5. Esto tiene implicaciones importantes, ya que, en pH fisiológico, los aminoácidos presentan ambos grupos, tanto el ácido carboxilo como el grupo amino, completamente ionizados. Por lo tanto, disueltos en agua, los aminoácidos existen como iones bipolares, moléculas también llamadas zwitteriones, las cuales pueden actuar como ácidos o como bases.
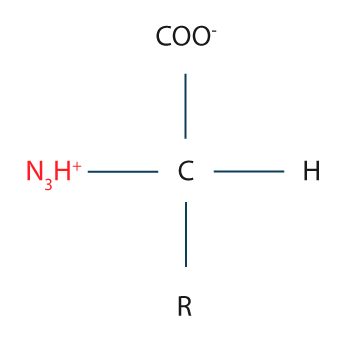
Forma neutra o zwitterión de los aminoácidos
La curva de titulación es un método que nos permite determinar la acidez o basicidad de un compuesto mediante una reacción de neutralización. Con base en las propiedades antes mencionadas, los aminoácidos también tienen curvas de disociación.
Tomemos como ejemplo la glicina (véase la siguiente figura). Cuando se encuentra a pH bajo (< 2), el grupo carboxilo no se ha disociado, por lo que el aminoácido presenta carga positiva (del grupo amino). Conforme se agrega una base fuerte, el grupo carboxilo se disocia y la glicina empieza a aparecer en su forma neutra porque poseerá una carga negativa (del grupo carboxilo) y una positiva (del amino). Si se sigue agregando la base, el pH sigue aumentando (> 9.5) y el grupo amino comienza a disociarse y la glicina ahora se encuentra con carga negativa.
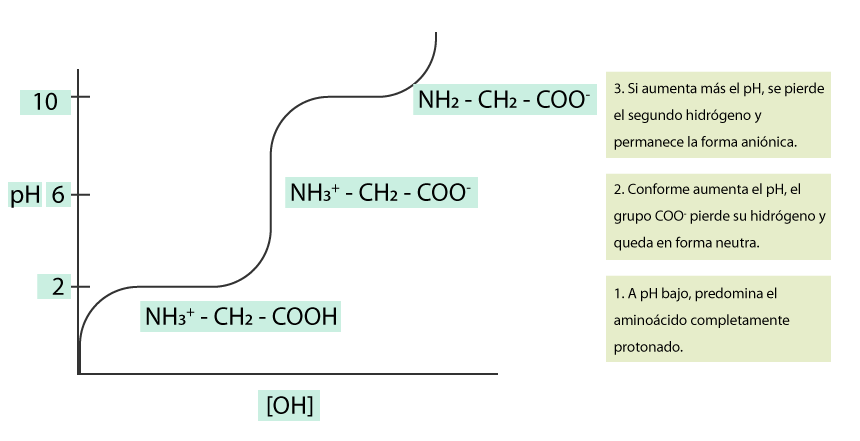

Curva de titulación de la glicina
A un pH bajo (1), la glicina se encuentra en su forma protonada: un protón en el grupo amino y uno en el carboxilo. Conforme se agrega base, el protón del grupo carboxilo se pierde y queda la forma neutra (2). Conforme se sigue agregando base, se pierde el protón del grupo amino y queda la forma aniónica o negativa (3). El pH en el cual el aminoácido no tiene carga se denomina punto isoeléctrico (pI). En la curva de disociación, existe un punto de este tipo, el cual representa el pH en el que el aminoácido no tiene carga eléctrica (véase la siguiente figura). Para calcular el pI, se puede utilizar la siguiente fórmula:
pI =
(pK1 + pK2)
2
Consideremos ahora un aminoácido con carga. El pK del grupo amino o carboxilo de la cadena lateral varía levemente comparado con los que se encuentran unidos al carbono α, por lo que existen tres valores de pK. Consideremos un aminoácido que posea un grupo carboxilo en la cadena lateral. En este caso, la curva de disociación del aminoácido será como se presenta en la siguiente figura. El pI no es el promedio de pK1 y pK2, ni siquiera el de pK1, pK2 y pKR, sino es el de los pK entre los cuales se encuentra el aminoácido neutro. En este caso, sería entre el pK1 y pKR.
Curva de titulación de un aminoácido con carga negativa
Inicialmente, a un pH menor de dos, tanto del grupo carboxilo unido al carbono α como el de la cadena lateral se encuentran protonados. Conforme el pH comienza a aumentar, primero se desprotona el carboxilo del carbono α, dando origen a un zwitterión. Si el pH sigue aumentando, el carboxilo de la cadena lateral pierde su hidrógeno y queda con carga negativa de -1. Si el pH aumenta por arriba de 9.5, el grupo amino también pierde un protón y, por lo tanto, queda un aminoácido con carga negativa de -2. El pI se calcula con el promedio de pK1 y pKR porque entre estos dos valores se encuentra la forma neutra del aminoácido.
Es importante que identifiques qué son los aminoácidos y que las propiedades químicas de su cadena lateral permiten su clasificación; además, esto te permitirá abordar, de mejor manera, el tema de proteínas (de suma importancia, ya que alguna alteración de éstas puede conllevar la aparición de enfermedades), porque los aminoácidos son los que se encargan de formar las proteínas a través de su unión.
Los aminoácidos esenciales son aquellos que no se pueden sintetizar en el cuerpo humano; por lo tanto, es necesario obtenerlos a partir de la dieta. A continuación, se presentan los 20 aminoácidos que constituyen las proteínas corporales. Clasifícalos de acuerdo con si son esenciales o no.
Los aminoácidos son las unidades componentes de las proteínas, por lo que son indispensables para el cuerpo humano; por ello, es la importancia del tema.
Fuentes de información
Brown, T. E., LeMay, H. E., Bursten, B. E., Murphy, C., Woodward, P. y Stoltzfus, M. E. (2018). Chemistry. The central science (14.a ed.). Pearson.
Harvey, R. A. y Ferrier, D. R. (2011). Bioquímica. Lippincott Williams and Wilkins.
Nelson, D. L. y Cox, M. M. (2013). Lehninger. Principles of biochemistry (6.a ed.). W. H. Freeman and Company.
Voet, D. y Voet, J. G. (2010). Biochemistry (6.a ed.). John Wiley and Sons.
Cómo citar
Perea, V. G., Ramírez, D. y Díaz, J. C. (2022). Aminoácidos. Unidades de Apoyo para el Aprendizaje. CUAIEED/Facultad de Medicina-UNAM. (Vínculo)