En este tema revisaremos los fundamentos de la genética moderna, es decir, el estudio de
los mecanismos de herencia propuestos por Gregor Mendel en el siglo XIX. La teoría de
Mendel fue producto de extensivos experimentos con cruzas de plantas de chícharos, seguidos de
un minucioso análisis matemático de las proporciones de rasgos de las plantas. La idea
revolucionaria de Mendel recaía en considerar a los rasgos heredables como partículas
discretas; en otras palabras, como entidades que se heredan completas e independientes.
Estos hallazgos resultan aún más sorprendentes si consideramos que realizó sus experimentos casi
100 años antes del descubrimiento del ADN como la molécula encargada de la herencia.
A pesar de ser ignorado inicialmente, el modelo de Mendel ha soportado la prueba del tiempo,
puesto que las predicciones hechas, a partir de la herencia de los caracteres, se cumplieron. Al
modelo de herencia, basado en los estudios de Mendel, donde una característica es efecto de un
solo gen, se le conoce como herencia mendeliana simple, y en las siguientes secciones
cubriremos sus principales elementos.

Identificar los fundamentos de la herencia mendeliana simple, de acuerdo con la frecuencia del padecimiento en el árbol genealógico y los cuadrados de Punnet, para entender el asesoramiento genético que se brinda a personas con antecedentes familiares de alteraciones genéticas de base mendeliana.
La información genética se encuentra almacenada en la molécula del ADN. En los
seres humanos la información genética está organizada en 23 pares de cromosomas: 22 autosomas
y un par de cromosomas sexuales. Los humanos poseemos un par de cada cromosoma
(denominados cromosomas homólogos), puesto que heredamos uno de cada uno de nuestros
padres, y al poseer dos juegos completos de cada uno de los cromosomas se nos considera
organismos diploides (simbolizado como 2n). Debido a esto, para cada gen poseemos dos
variantes o alelos, heredados de cada padre
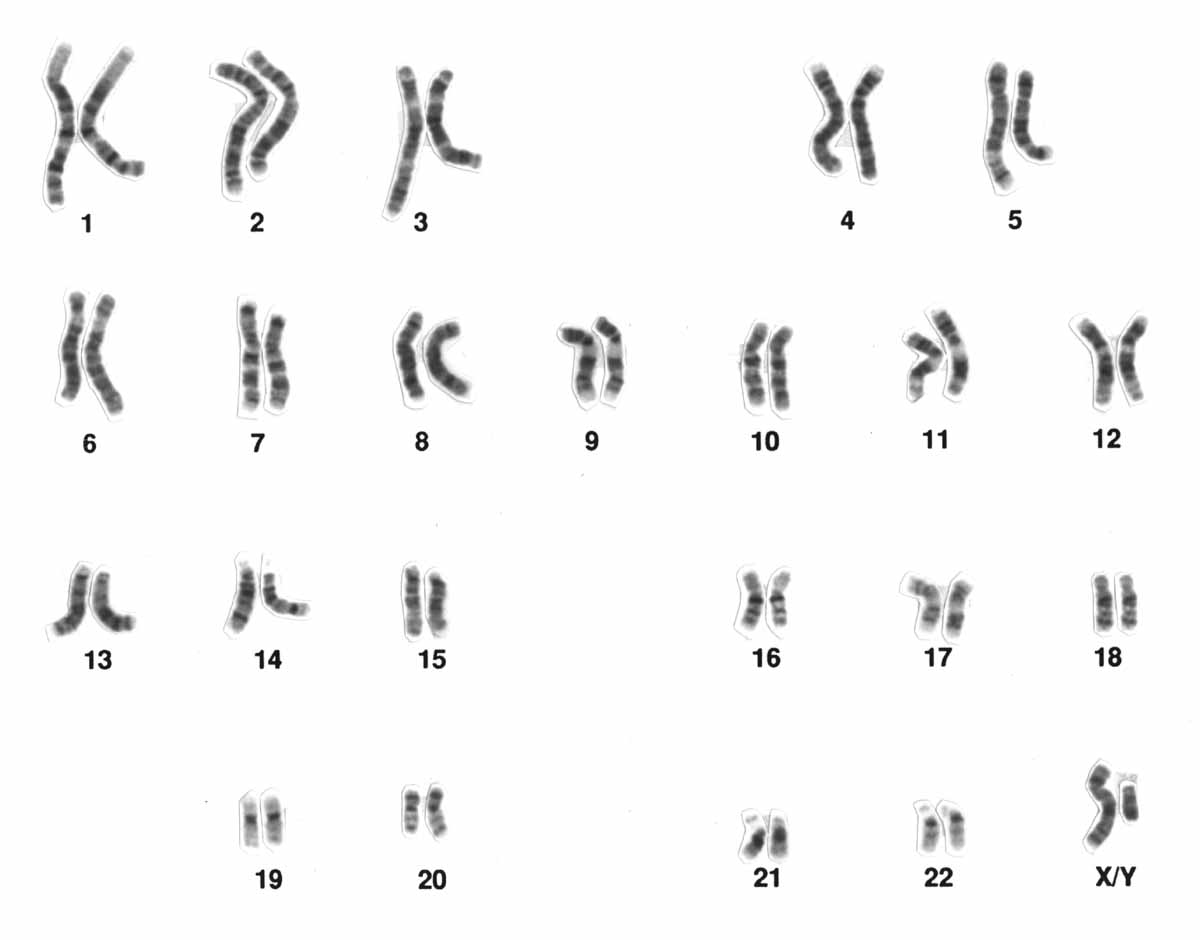
National Human Genome Research Institute. (2016). Cromosomas
humanos [ilustración]. Tomada de
https://commons.wikimedia.org/wiki/File:Human_male_karyotpe_high_resolution.jpg#mw-jump-to-license
Durante la reproducción sexual se generan gametos, a través de la meiosis, con la mitad del complemento genético; es decir, que contienen 23 cromosomas sencillos (haploides, 1n) y, por tanto, sólo uno de los alelos de cada gen que poseía el progenitor.
La finalidad de la meiosis, entre otras cosas, es la de permitir que durante la fecundación se reconstituya el complemento cromosómico diploide de la especie: diploide en el caso de los humanos y la mayoría de los mamíferos (1n + 1n= 2n). Durante la meiosis, cada uno de los dos alelos de cada padre se segrega de manera separada; este principio corresponde a la primera ley de Mendel o la de la segregación igualitaria.
Este fenómeno de segregación ocurre para cada par de alelos/genes; de hecho, cada par de alelos se segrega de forma independiente, respecto a distintos pares de alelos. Esta segregación independiente de alelos durante la formación de gametos es la base de la segunda ley de Mendel.
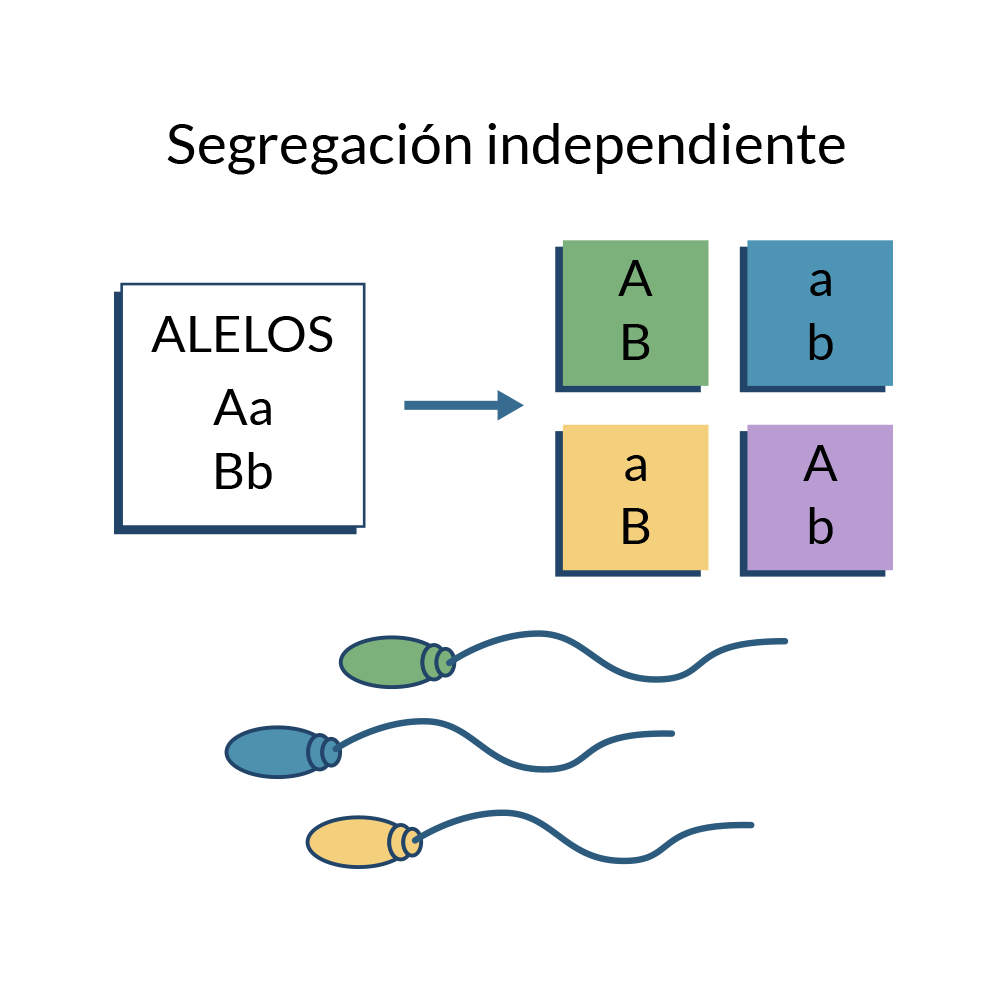
Segregación independiente
Durante la fecundación, el nuevo organismo recibe un alelo de cada progenitor; de acuerdo con las leyes de Mendel puede recibir dos alelos idénticos, lo que se denomina homocigo/homocigoto. Por otro lado, puede recibir dos alelos diferentes en una condición llamada heterocigo/heterocigoto. La combinación de todos los alelos o, mejor dicho, a todo el complemento cromosómico de un organismo se le conoce como el genotipo. En los experimentos de Mendel cada gen/alelo codificaba para una característica de la planta, como la altura, color de la flor, textura de la semilla, etc. A esta representación física del genotipo se le denomina fenotipo; dicho de otra manera, el genotipo es la información en forma de ADN; mientras que el fenotipo es lo que se observa. Los caracteres heredados (fenotipo), dependerán de cómo interactúe cada par de alelos (genotipo). En las siguientes secciones se abordarán los mecanismos más comunes de herencia.
Debemos recordar que los genes codificarán ARN, y que algunos de estos serán traducidos en proteínas con diferentes funciones:
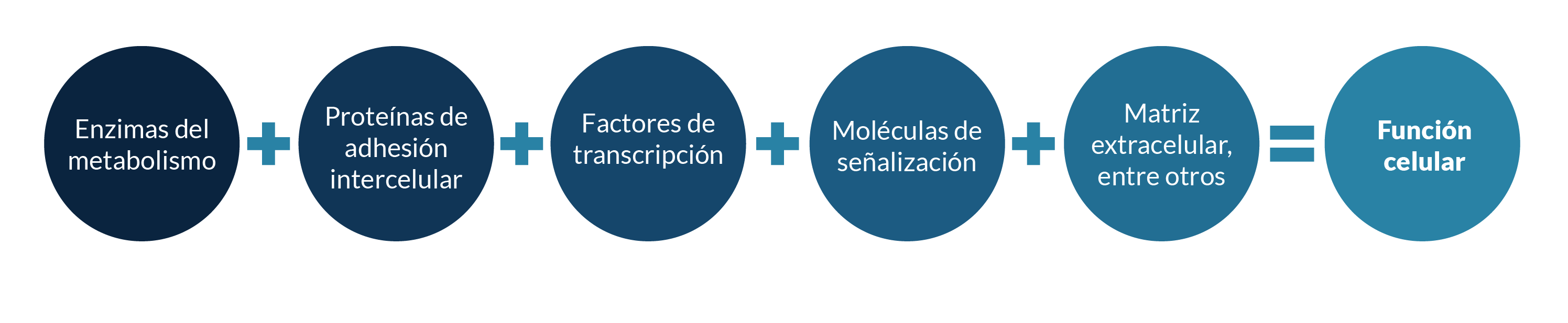
La función celular normal depende de que la actividad de estas proteínas se realice en tiempo, forma y lugar requerido.
Sin embargo, estos genes son susceptibles a sufrir mutaciones; es decir, cambios de la secuencia
del ADN genómico heredables y permanentes. Estas mutaciones pueden generar cambios en la
actividad de las proteínas a nivel de ganancia de función (por ejemplo, un receptor de membrana
activo independientemente de la presencia de ligando), de pérdida de función (por ejemplo, una
enzima incapaz de transformar un substrato) o sin alteración de la función. A la forma “normal”
de un gen se le denomina silvestre (también llamado WT, por wild
type); mientras que a la versión “alterada” se le denomina mutante
(Mut).
Dependiendo de la importancia del gen dentro de la función celular, la presencia de vías
alternas dentro del proceso, la expresión y actividad intrínseca de la proteína, podemos hablar
de fenómenos de haplosuficiencia y haploinsuficiencia, en el caso de una mutación en un gen. En
la haplosuficiencia una copia WT puede rescatar el fenotipo y no se presenta la patología;
mientras que en la haploinsuficiencia la sola presencia de una copia mutante es la responsable
de la aparición del fenotipo deletéreo, sin importar la presencia de una copia WT.
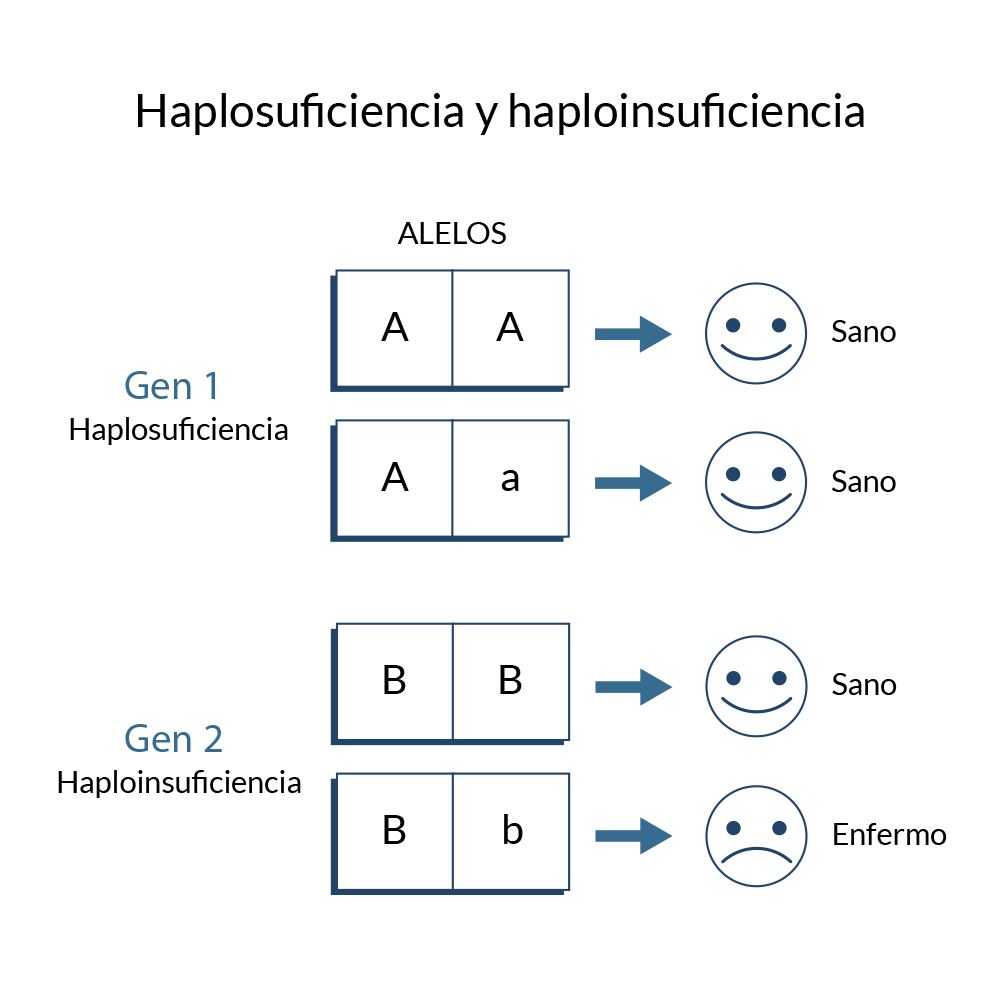
Haplosuficiencia y haploinsuficiencia
Aunque los experimentos realizados en plantas por Mendel son bastante ilustrativos, por no
decir elegantes, la demostración de los patrones de herencia resulta interesante para las
personas, sobre todo útil para el médico y el estudiante de medicina: familiarizarse con
ejemplos de genética médica. De manera que el genetista tiene que recurrir al estudio de los
antecedentes familiares del paciente o individuo de interés; este tipo de estudios se les
conoce como análisis de pedigrí, comúnmente llamado árbol genealógico. El
análisis puede revelar valiosa información sobre el mecanismo de herencia que sigue un rasgo
en particular.
Genética humana
A partir de los análisis de los árboles genealógicos podemos establecer tres tipos de
herencia en el caso de las enfermedades genéticas:
| Autosómica dominante | Autosómica recesiva | Ligada al sexo |
Considerando esto, se puede hacer un estimado de la probabilidad de que el producto de una pareja presente un padecimiento genético, empleando un diagrama de Punnett. Estos diagramas son la representación gráfica de las posibles combinaciones de alelos, la probabilidad de generar un genotipo/fenotipo, depende del área que éste ocupe en la cuadrícula. Es importante recordar que dentro del cuadrado de Punnet se habla de porcentajes como probabilidades y que cada nuevo hijo tiene las mismas probabilidades de estar sano o afectado, independientemente si hubo uno sano o enfermo, anteriormente.
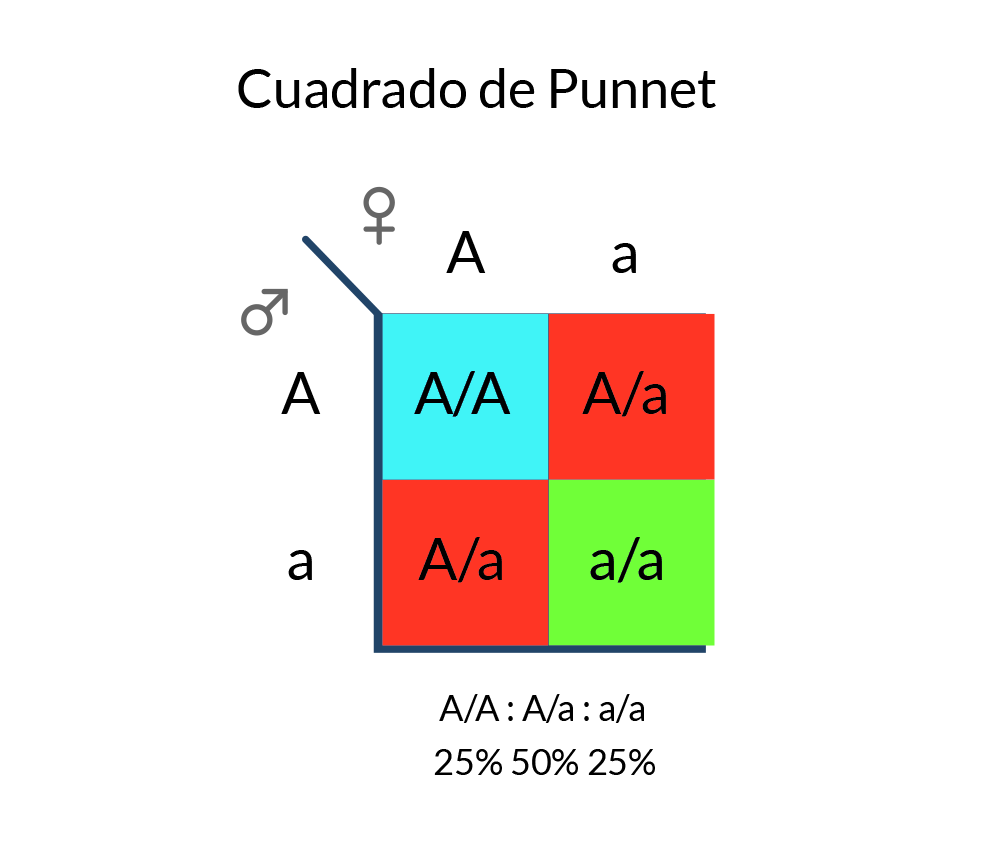
Cuadrado de Punnet
Dentro de la exploración clínica y la generación de los árboles genealógicos de las enfermedades genéticas debemos de reconocer dos términos importantes: penetrancia y expresividad.
Penetrancia
Es la probabilidad de que un sujeto que posea genotipo afectado presente el fenotipo
esperado. Es importante mencionar que no siempre los sujetos que tengan el alelo alterado
presentarán las características clínicas, por lo que este porcentaje suele ser menor al 100%
y se denomina penetrancia reducida o incompleta. En la mayoría de las ocasiones la aparición
del fenotipo depende de la edad, por ejemplo, en el caso del xeroderma pigmentoso las
características fenotípicas se acentúan con la edad; sin embargo, en la polidactilia los
defectos son congénitos, esto es, están presentes al nacer.

Halpern, J., Hopping, B. y Brostoff, J. (2008). Fotosensibilidad,
cicatrización de la córnea y retraso del desarrollo por Xeroderma Pigmentoso en un
país tropical [fotografía]. Tomada de
https://commons.wikimedia.org/wiki/File:Xeroderma_pigmentosum_01.jpg
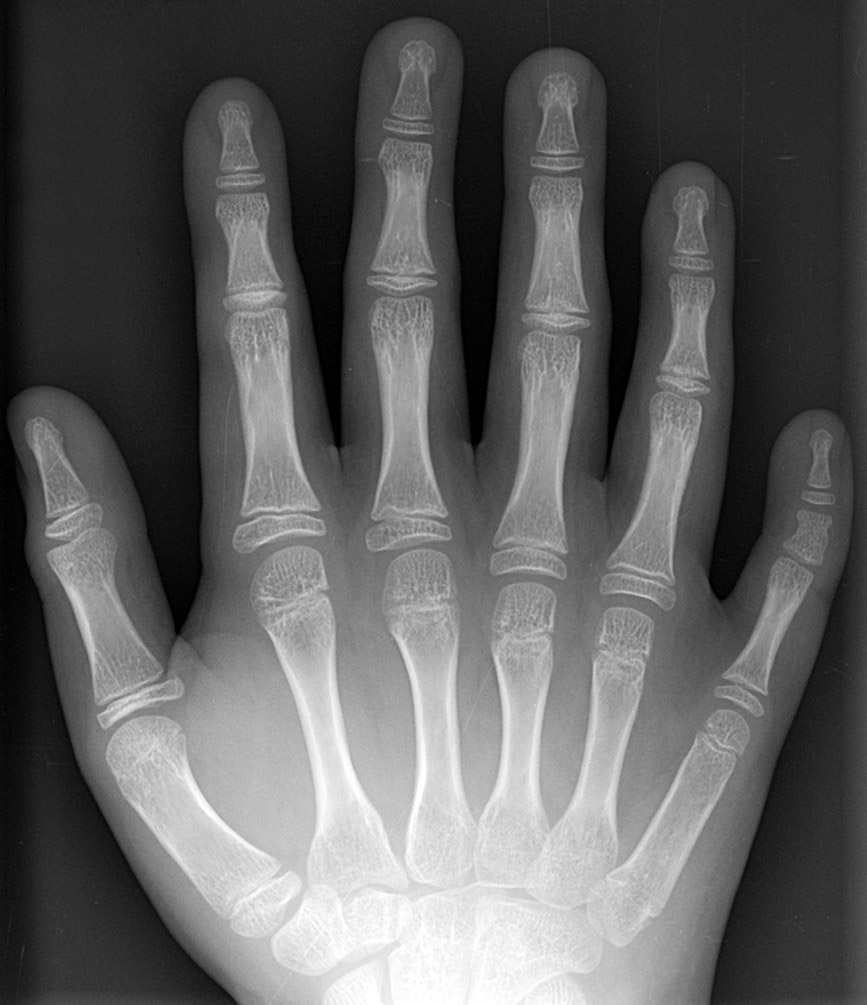
Manske, M. (2005). Caso de polidactilia [fotografía]. Tomada
de https://es.m.wikipedia.org/wiki/Archivo:Polydactyly_01_Rhand_AP.jpg
Expresividad
Se refiere a la gravedad de la expresión del fenotipo, es
decir, no todos los pacientes que presenten un alelo mutante presentarán el mismo
fenotipo. Por ejemplo, en el caso de la neurofibromatosis tipo I, algunos pacientes sólo
poseerán las manchas cafés con leche, características; mientras que otros presentarán
neurofibromas plexiformes. Cuando varias personas presentan el mismo genotipo, pero
diverso fenotipo, hablamos de expresividad variable.
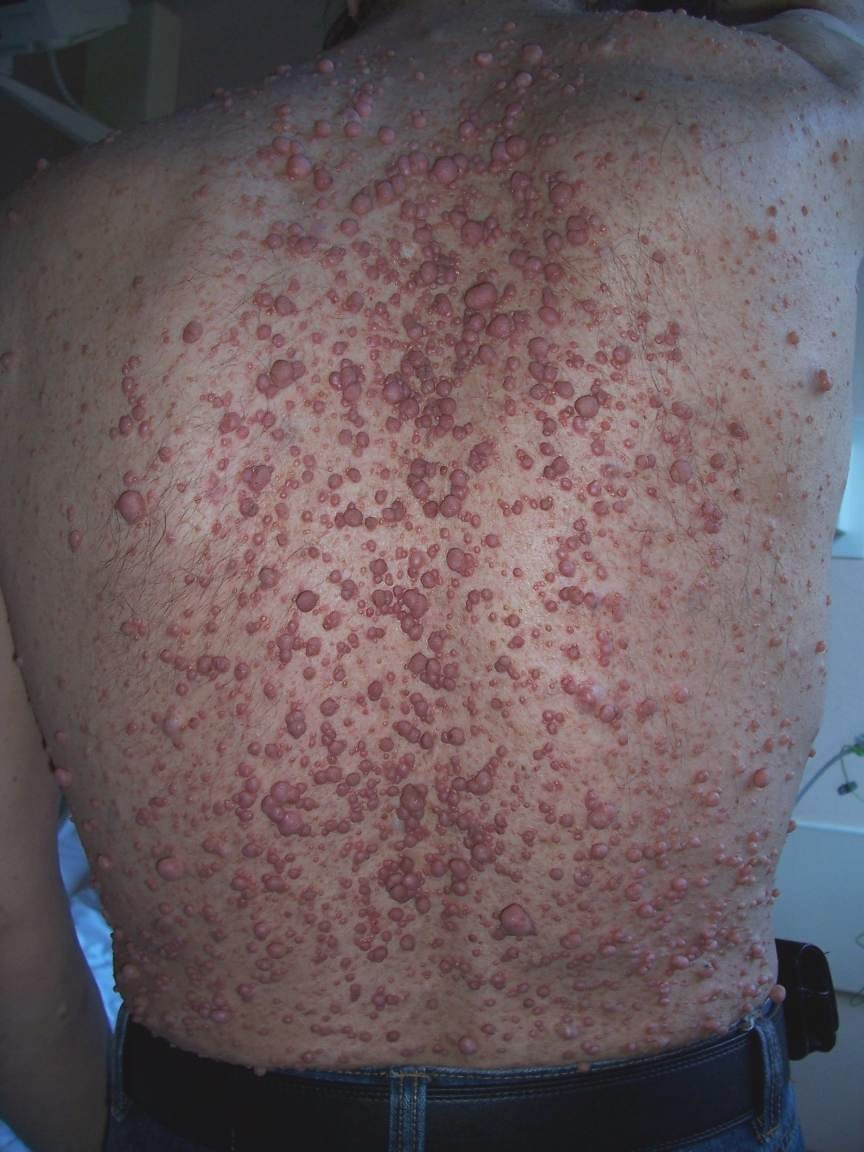
Klaus, D. (2009). Caso de neurofibromatosis tipo I
[fotografía]. Tomada de
https://commons.wikimedia.org/wiki/File:Neurofibroma02.jpg
Este tipo de herencia se debe a mutaciones localizadas en un locus en cualquiera de los 22 pares de autosoma. Los padecimientos con este tipo de herencia se manifiestan con una sola copia mutante del gen, es decir, basta con que uno de los padres herede el alelo afectado para que el producto manifieste la enfermedad. Síndromes con este tipo de herencia se caracterizan por afectar tanto a hombres como mujeres; además, suelen presentarse casos en todas las generaciones, donde padres afectados heredan la enfermedad a sus hijos.
Al realizar el diagrama de Punnet para este caso obtenemos la misma distribución de genotipos para dos padres afectados (A/a). 25 % homocigotos sanos (a/a), 50 % heterocigotos afectados (A/a) y 25% homocigotos afectados (A/A). Sin embargo, al hacer la determinación de los fenotipos no se observa el esperado 1:3 (sanos:enfermos); sino que las proporciones son más cercanas a 1:2. Esto se debe a que el fenotipo producido por A/A es tan severo que no es compatible con la vida y no llega a término; siendo únicamente viables los genotipos a/a (no afectado) y A/a (afectado).
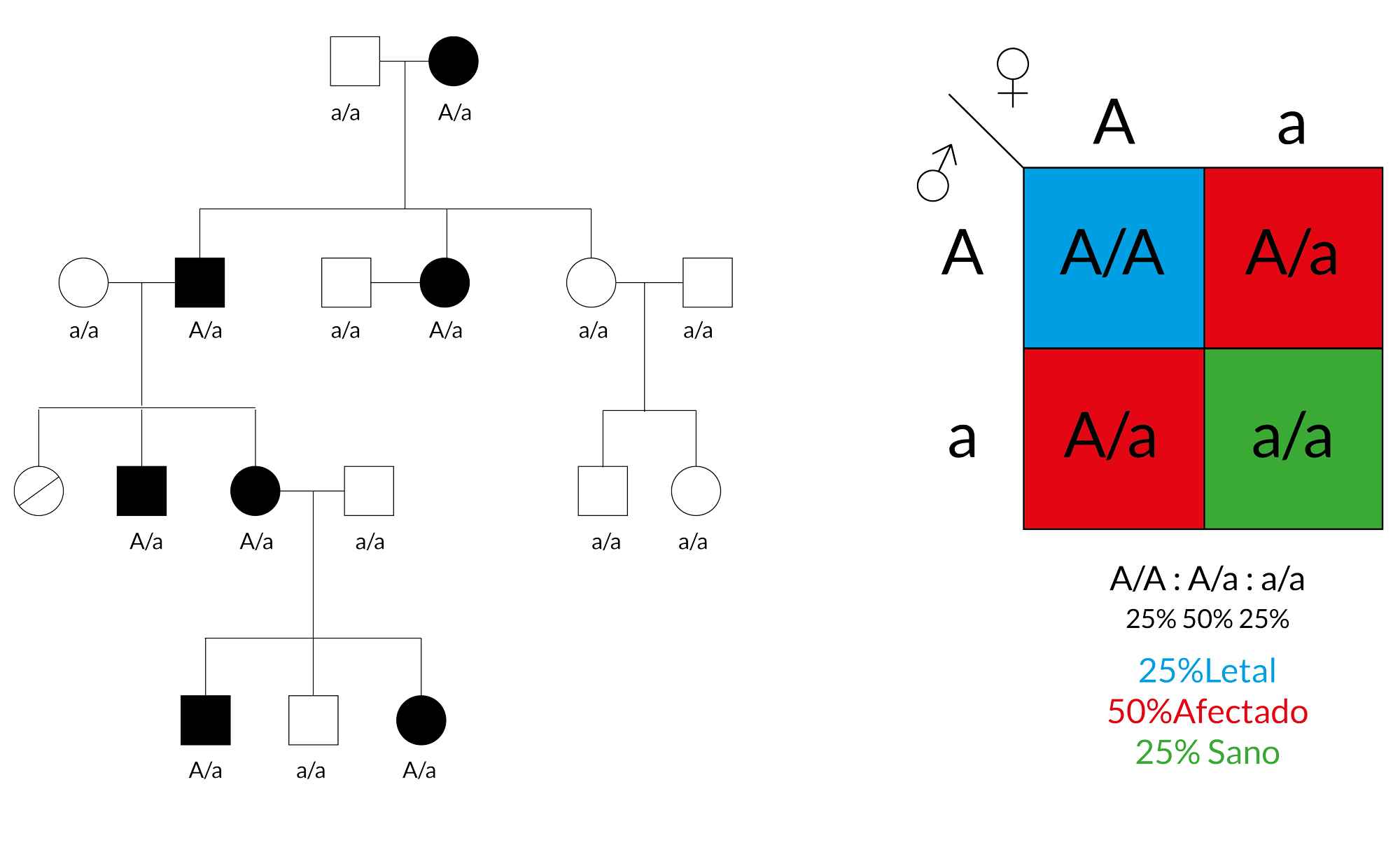
Autosómica dominante
Algunos ejemplos adicionales de enfermedades con este mecanismo de herencia son:
Proteína intercelular de interacción con la matriz extracelular y regulador de la señalización de TGFb. Esta alteración está asociada al proceso de osificación, por lo que los afectados, principalmente, presentan alteraciones esqueléticas.
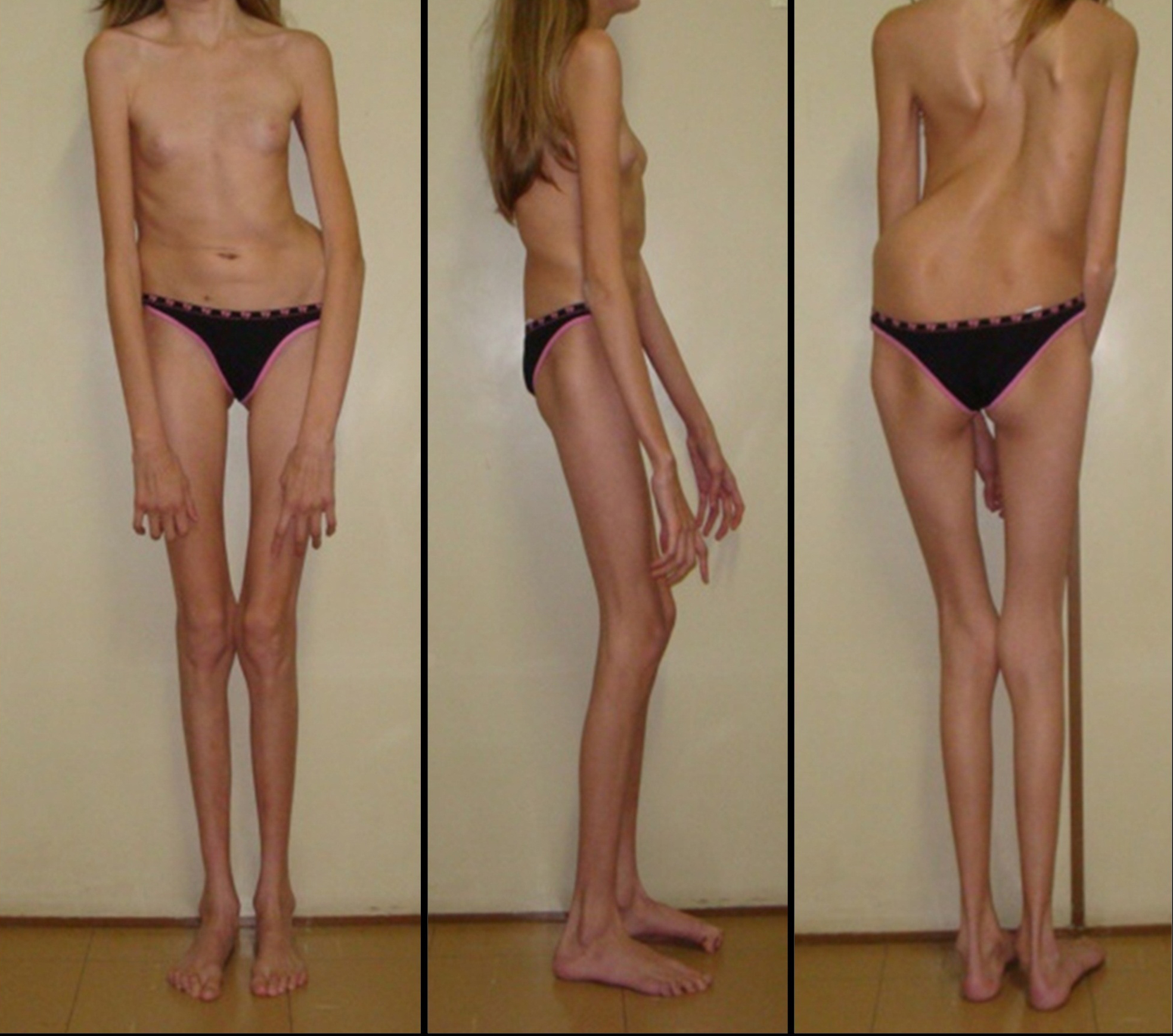
Colovati, M. (2009). Alteraciones esqueléticas
por síndrome de Marfan [fotografía]. Tomada de
https://commons.wikimedia.org/wiki/File:Marfan_Patient.jpeg
Alteración genética caracterizada por la presencia de zonas hiperpigmentadas (manchas cafés con leche), nódulo de Lisch y tumores fibromatosos. El gen afectado es un regulador de la función de algunas GTPasas requeridas para proliferación celular.
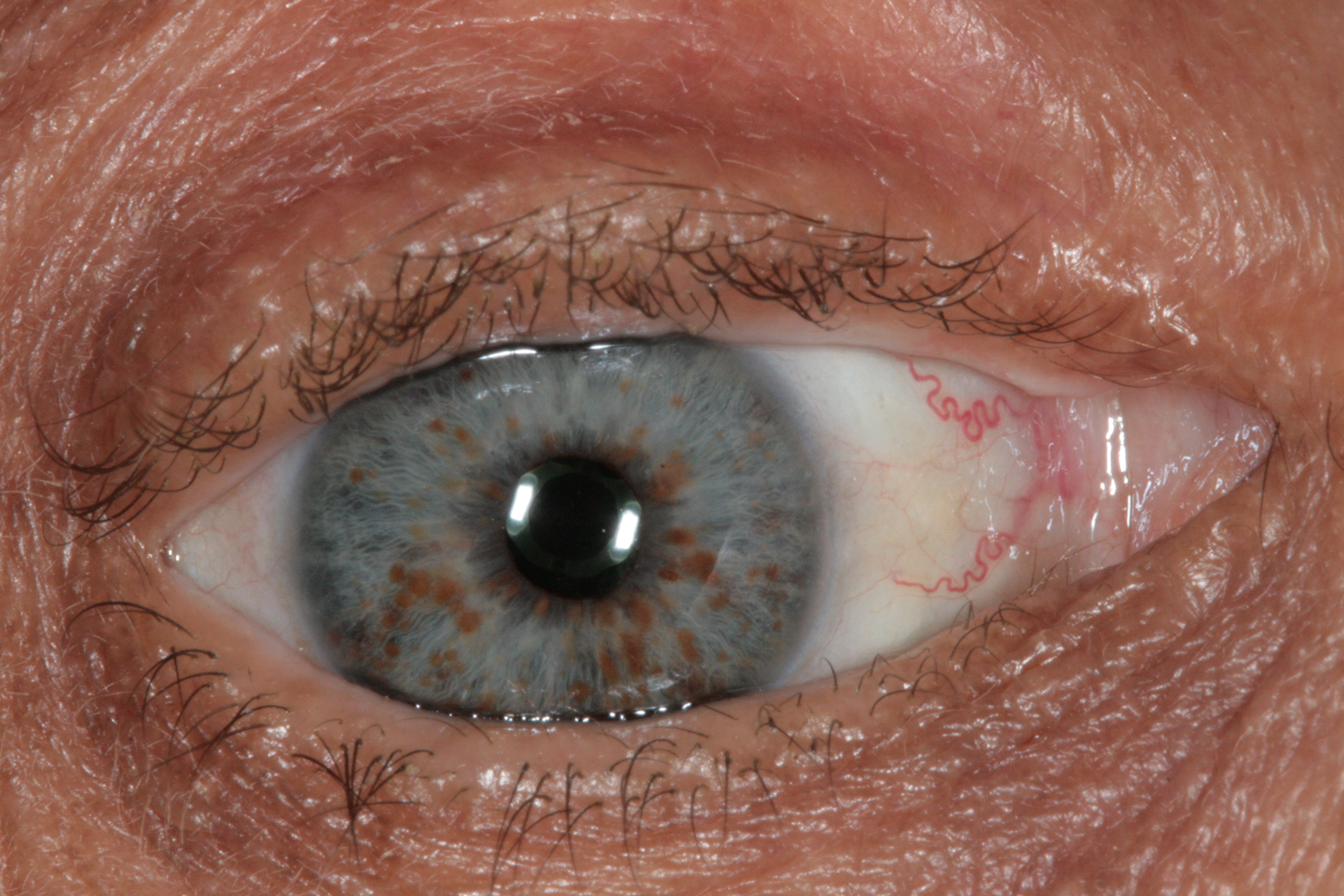
Malamos, D. (2015). Nódulo de Lisch por
Neurofibromatosis tipo I [fotografía]. Tomada de
https://commons.wikimedia.org/wiki/File:Lisch_nodules.JPG
Trastorno neurodegenerativo y progresivo caracterizado por la presencia de corea, rigidez muscular y demencia. El gen afectado es regulador de la expresión génica, a través de unión a factores de transcripción.
Fundación Mexicana para la Enfermedad de
Huntington. (2013). ¿Qué es la enfermedad de Huntington?
[Archivo de video]. Consultado de https://youtu.be/CAjHAp6lR0M
Miembro de la vía de señalización de hedhegog, involucrada en el establecimiento del eje anteroposterior de la extremidad.

Manske, M. (2005). Caso de polidactilia
[fotografía]. Tomada de
https://es.m.wikipedia.org/wiki/Archivo:Polydactyly_01_Rhand_AP.jpg
Mayor componente de los gránulos de queratohialina en el estrato granuloso de la epidermis. En este padecimiento las células de la epidermis son incapaces de poder desprenderse del estrato córneo de manera adecuada.
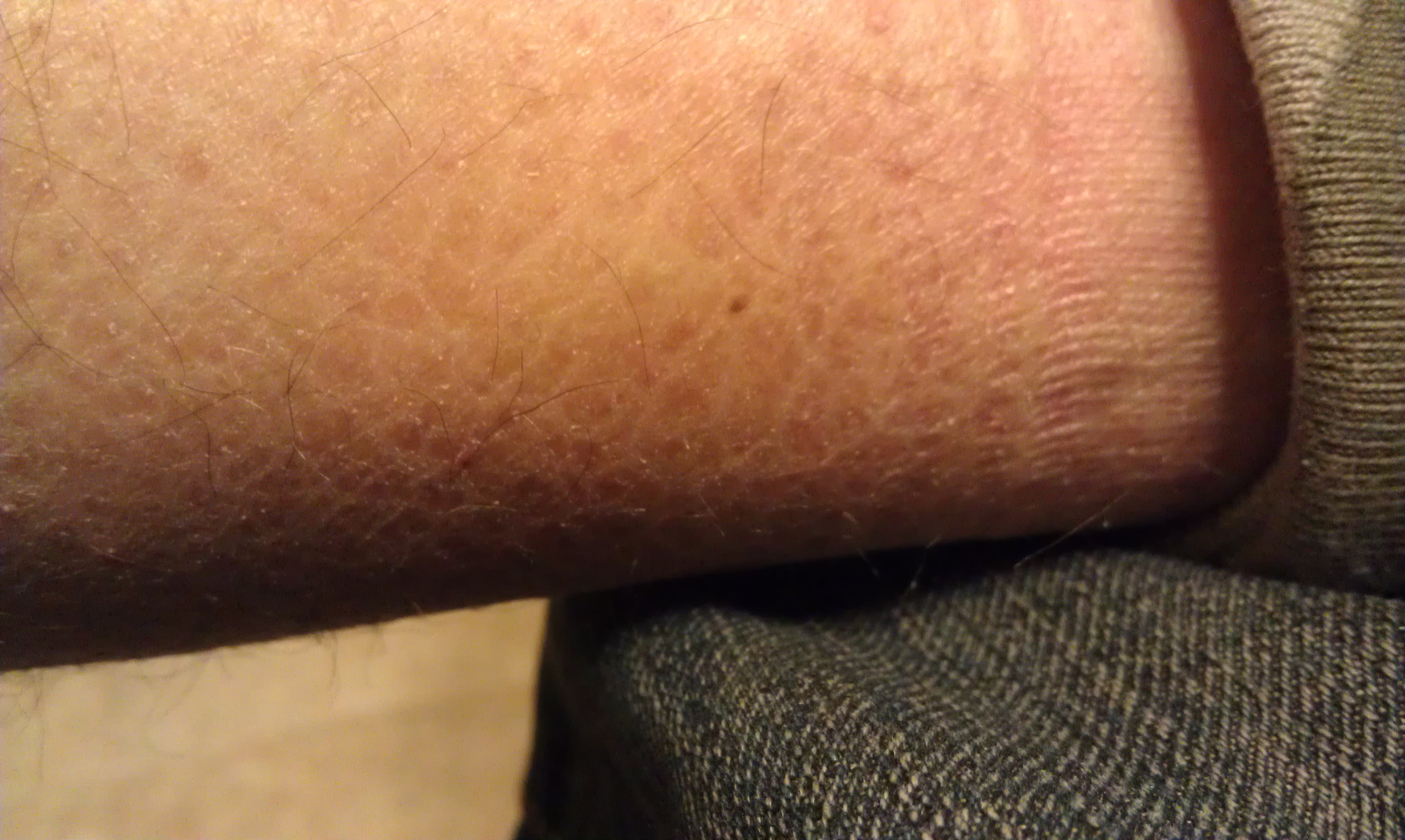
Skoch3. (2012). Ictiosis vulgar
[fotografía]. Tomada de
https://commons.wikimedia.org/wiki/File:2012_April_mosaic_lines_left_calf.jpg?uselang=es
Para el caso de las enfermedades autosómicas dominantes, las personas homocigotas presentan una afectación más grave que los heterocigotos, como es el caso de la acondroplasia; cuando sólo uno de los alelos está afectado se presenta la acondroplasia, pero cuando los dos alelos están afectados resulta letal para el producto. Sin embargo, cuando el fenotipo es similar, independientemente del tipo de genotipo heterocigoto u homocigoto, se le denomina dominante pura, como es el caso de la enfermedad de Huntington.
Imaginemos el caso de la enzima fenilalanina hidroxilasa (12q23.2), que cataliza la conversión de fenilalanina en tirosina, si un individuo hereda dos copias normales para el gen que la codifica resulta homocigoto para la forma WT (WT/WT) y presentaría un fenotipo normal (metabolismo de la fenilalanina), puesto que dispone de dos copias intactas de la enzima. Para esta enzima, un individuo heterocigoto con un alelo WT y uno mutante (WT/Mut), también presentaría (en la mayoría de los casos) un fenotipo normal; el alelo funcional (WT) es capaz de suplir la función del alelo defectuoso (haplosuficiencia). Por otro lado, si un individuo hereda dos copias defectuosas (Mut/Mut); al carecer de al menos de una copia funcional, presentaría un fenotipo patológico (incapaz de metabolizar la fenilalanina en tirosina), por la falta total de la actividad de esa enzima. En este caso, el alelo mutante es recesivo al alelo silvestre; la presencia del alelo WT “enmascara” la presencia del alelo mutante en el fenotipo.
En este caso, el alelo silvestre F (en mayúsculas) es dominante sobre el alelo defectuoso f (en minúsculas). Como puede observarse en el análisis del árbol genealógico, hay tanto mujeres como varones afectados; una característica a notar es que este tipo de enfermedades suelen presentarse, usualmente, en padres heterocigotos (F/f) sanos, pero que actúan como portadores del padecimiento. Una característica adicional es que la incidencia de estas patologías aumenta de manera significativa en uniones consanguíneas (entre parientes), debido a que la probabilidad de ser portadores del alelo defectuoso es mayor que entre la población general.
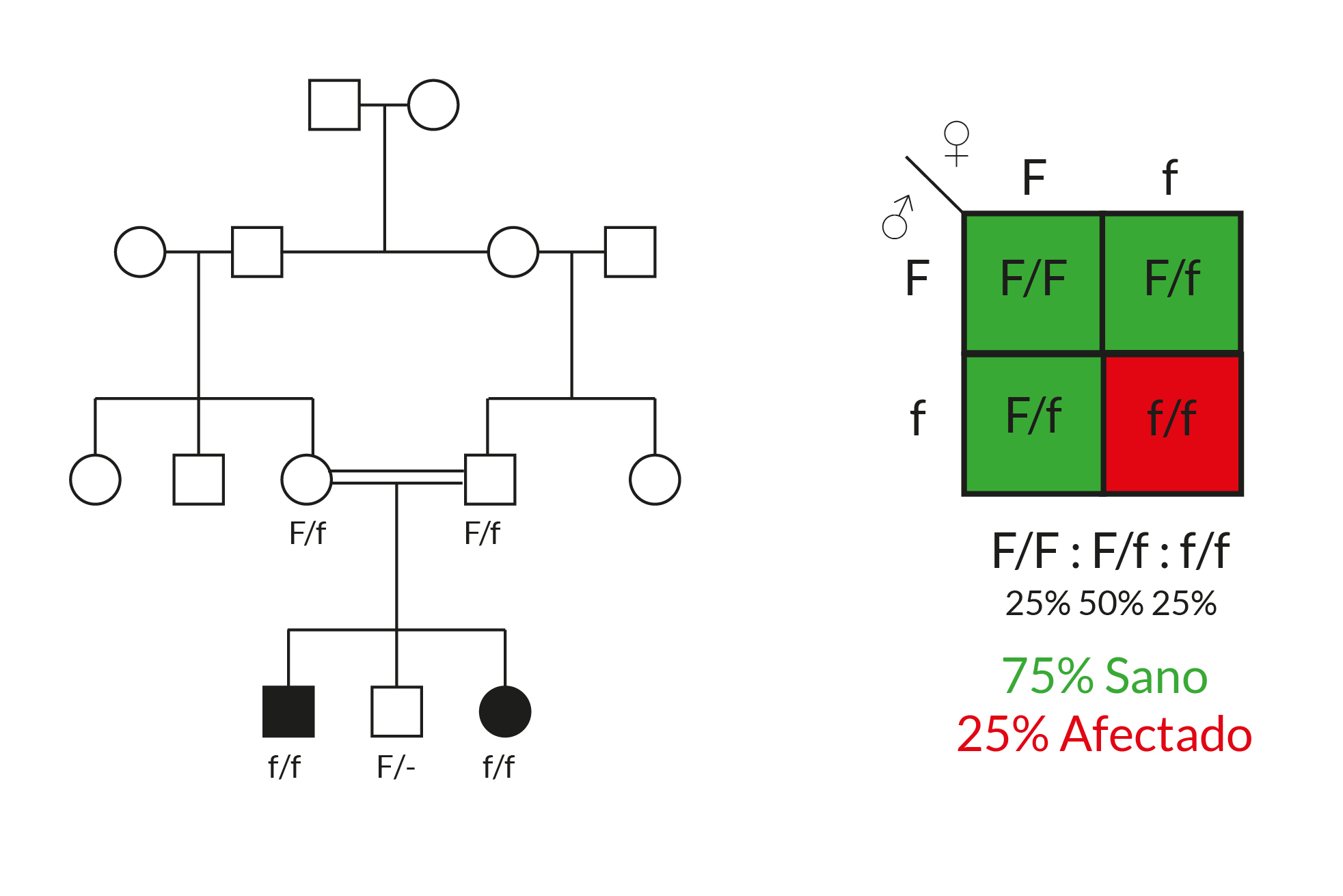
Autosómica recesiva
Para las enfermedades autosómicas recesivas y considerando que los padres son heterocigotos, la
probabilidad de presentar un hijo afectado (f/f) es 25 % o ¼ del área; el resto (75%),
son individuos sanos. De éstos 50 % son heterocigotos (F/f) portadores y 25 %
homocigotos sanos (F/F). Cabe resaltar que en casos reales, debido al número reducido de
hijos que tiene cada pareja, no es tan evidente observar esta distribución de fenotipos 3:1
(sanos:enfermos).
La mayoría de los defectos metabólicos (asociados a una
enzima/proteína) presentan este mecanismo de herencia. Algunos ejemplos adicionales son:
Canal selectivo de baja conductancia de cloro dependiente de ATP. La alteración de este canal disminuye la fluidez de los mucopolisacáridos (moco) en el medio extracelular, generando alteraciones en aparato respiratorio y digestivo.

Geiger, S. (2018). Alteraciones en aparato
respiratorio por Fibrosis quística [fotografía]. Tomada de
https://commons.wikimedia.org/wiki/File:2012_April_mosaic_lines_left_calf.jpg?uselang=es
Enzima parte del metabolismo de la tirosina en melanina. Esta alteración genera falta de pigmentación en todos los tejidos que, de manera normal, presentan melanina.

Babbur. (2018). Albinismo [fotografía].
Tomada de https://pixabay.com/photo-3438707
Enfermedad con heterogeneidad alélica; puede originarse por mutaciones en los miembros del complejo de la deshidrogenasa de los aminoácidos ramificados. Enfermedad asociada a retraso físico y mental, problemas de alimentación y la orina con olor a jarabe de arce.
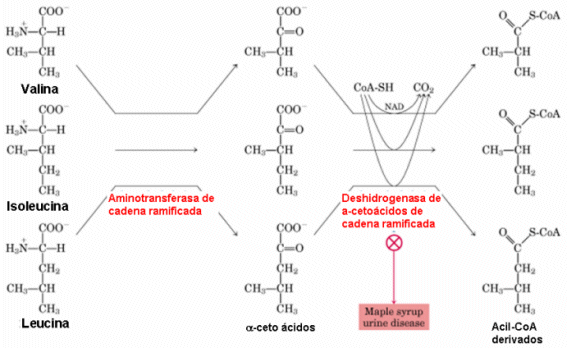
Universidad de Alcalá. (2014). Metabolismo de
aminoácidos ramificados [imagen]. Tomada de
http://www3.uah.es/bioquimica/Tejedor/BBM-II_farmacia/tema14-3.htm
Enfermedad en la que se ve alterada la estructura de la hemoglobina, pasando de un estado difusible (normal) a uno ordenado en forma de multímero (anormal) y que altera la morfología de los eritrocitos.
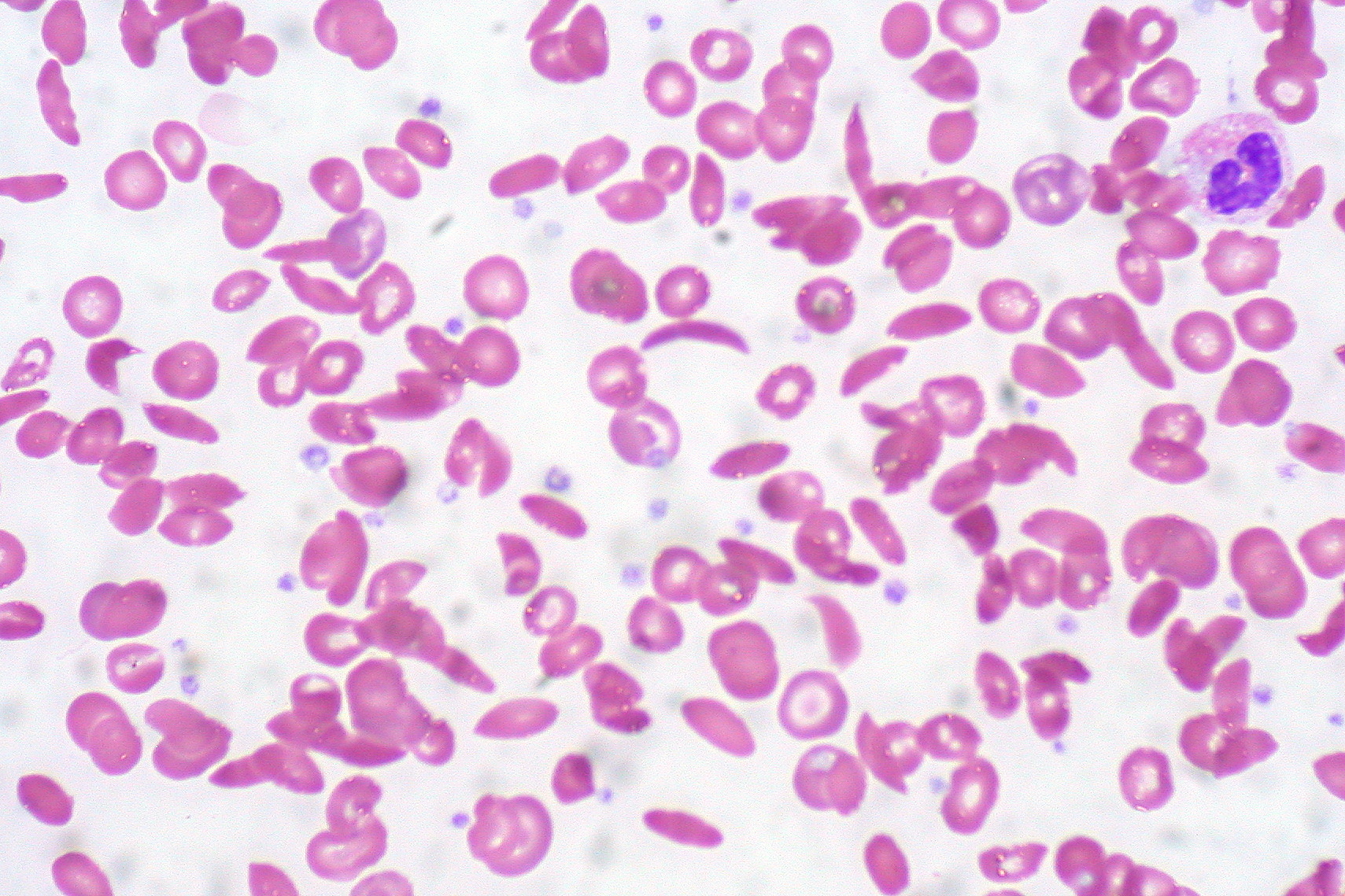
Uthman, E. (2011). Anemia de células
falciformes [imagen]. Tomada de
https://commons.wikimedia.org/wiki/File:Sickle_Cell_Anemia_(5610746554).jpg?uselang=es
Enzima parte del metabolismo de la galactosa. La alteración de este gen está asociada a alteraciones hepáticas, catarata y retraso mental en los neonatos.
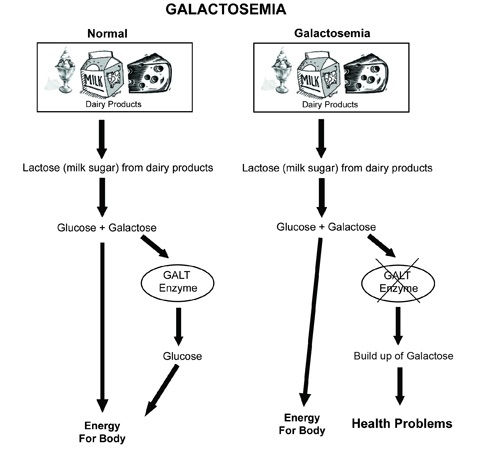
biochemist01. (2012). Galactosemia
[ilustración]. Tomada de
https://commons.wikimedia.org/wiki/File:Galactosemia_small_(2).jpg?uselang=es
A pesar de que las enfermedades autosómicas recesivas son más frecuentes en enlaces consanguíneos o en poblaciones endogámicas, en la población general sin este tipo de uniones también pueden presentarse. La aparición de este tipo de patologías es muy baja en la población general, debido a la baja frecuencia de los alelos mutantes en las poblaciones; sin embargo, cuando aparecen este tipo de síndromes, la mayor parte tienen un genotipo conformado por heterocigotos compuestos, es decir, presentan dos alelos mutantes en diferentes partes del mismo gen.
Los humanos poseemos un par de cromosomas sexuales XX para mujeres y XY para hombres, esto significa que las mujeres contienen dos alelos para genes presentes en el cromosoma X, mientras que los hombres sólo poseen uno (hemicigotos)

Heterocigoto/homocigoto/hemicigoto
Esto repercute profundamente en los patrones de herencia de enfermedades, cuyo gen causante tiene su locus en el cromosoma ‘X’. En un árbol genealógico, principalmente, se encuentran hombres afectados, dado que las mujeres tienen una copia de “respaldo” suelen actuar como portadoras. Usualmente, se transmite de madres portadoras a hijos, puesto que los varones afectados sólo transmiten un cromosoma ‘Y’ a sus hijos varones
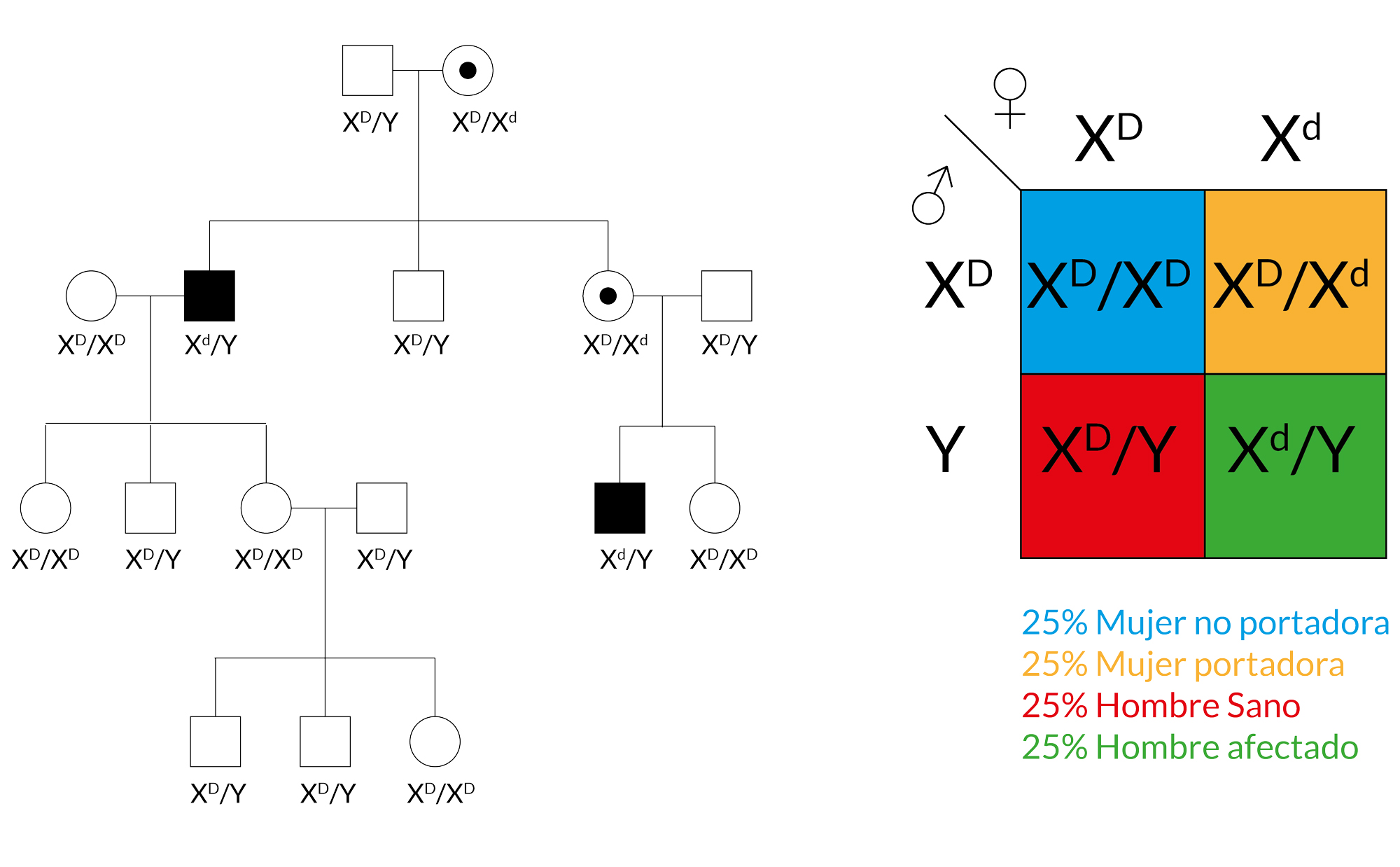
Ligado al sexo
Algunos otros ejemplos de enfermedades con este tipo de herencia son:
Proteína involucrada en la cascada de coagulación.
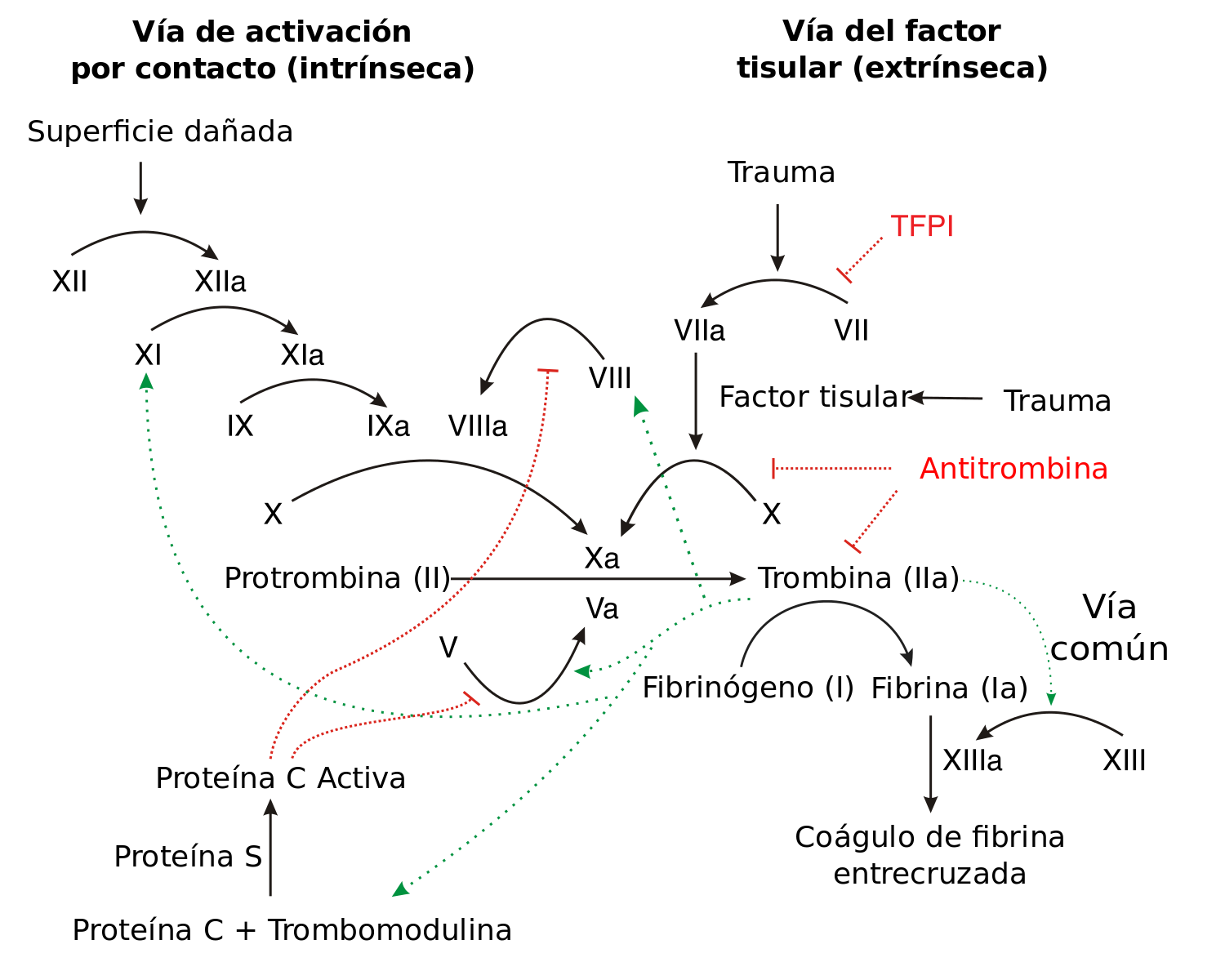
Joe, D. (2012). Hemofilia A [ilustración].
Tomada de
https://commons.wikimedia.org/wiki/File:Coagulation_full_ESP.svg
Proteína que participa en el complejo encargado de unir a las sarcómeras con el sarcolema. Pacientes con estos padecimientos poseen, como principales características de forma inicial, alteraciones de la marcha.
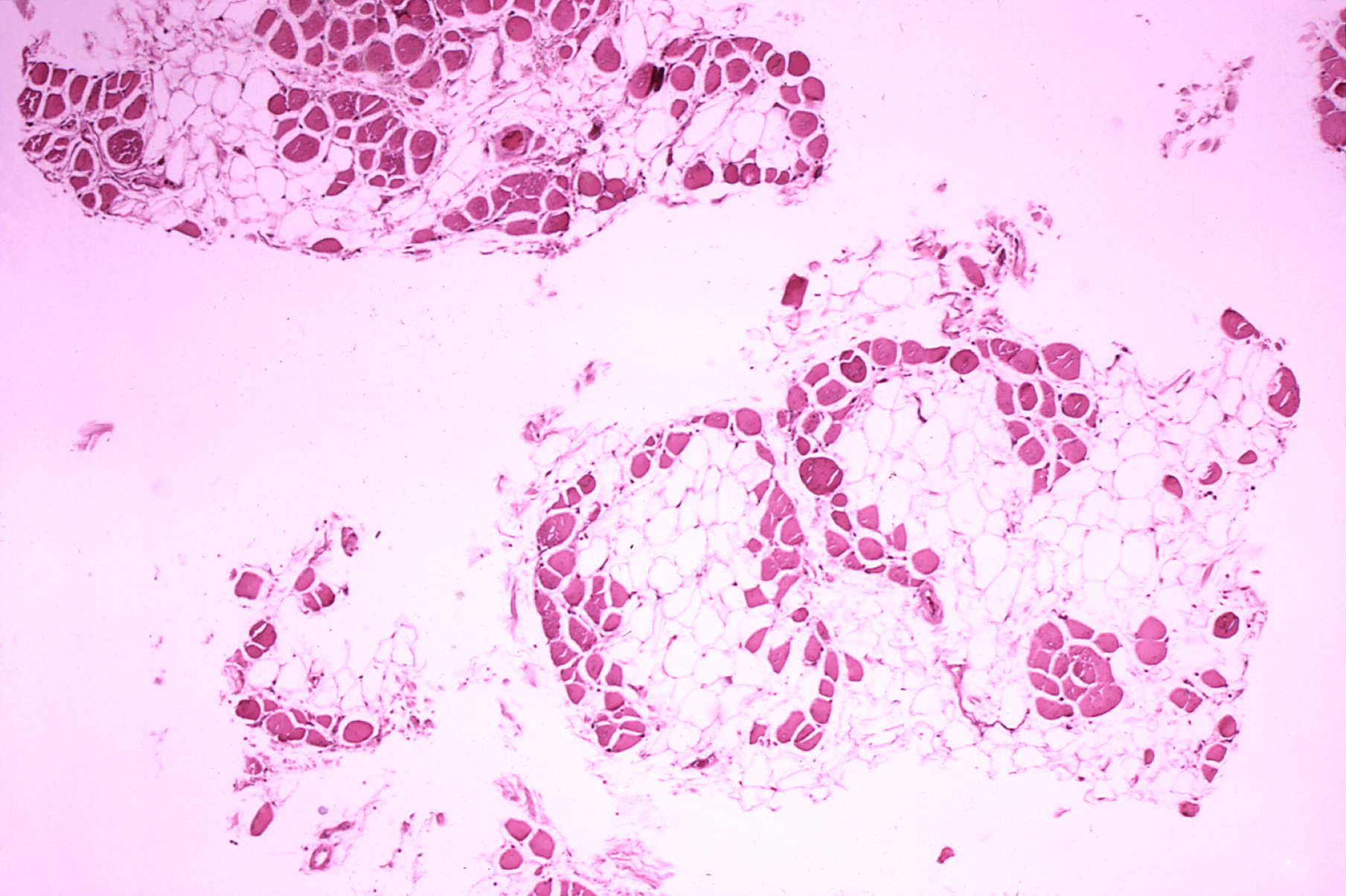
Ewing, E. (1972). Histopatología del músculo
gastrocnemio de un paciente con distrofia muscular
pseudohipertrófica, tipo Duchenne [imagen]. Tomada de
https://es.m.wikipedia.org/wiki/Archivo:Duchenne-muscular-dystrophy.jpg
Proteína de unión a las islas CG metiladas. Este padecimiento es una
alteración del neurodesarrollo asociado a retraso mental, regresión de
habilidades adquiridas y detención del desarrollo intelectual entre los 6 y
18 meses de edad. En esta patología las características clínicas son
variables y difieren entre cada uno de los pacientes, esto puede ser debido
a los diferentes papeles que tiene la proteína MECP2 en la función celular
de distintos tejidos.

Ehrhart, F.; Hanspers, K.; Willighagen, E.;
Kutmon, M. y Miller, R. (2015). Proceso que describe a la
proteína MECP2 y su participación con el síndrome de Rett en
humanos [imagen]. Tomada de
https://commons.wikimedia.org/wiki/File:WP3584.png
Acil CoA-transferasa de ácidos grasos de cadena larga de localización peroxisomal. Las manifestaciones primarias de este padecimiento se observan en la medula adrenal, la mielina del sistema nervioso central y las células de Leydig.

RicHard-59. (2011). Gen de la
adrenoleucodistrofia [ilustración]. Tomada de
https://en.wikipedia.org/wiki/File:ABCD1-gene.svg
Receptor nuclear con acción de factor de transcripción que responde a andrógenos como testosterona. Las pacientes presentan un cariotipo 46 XY, sin el desarrollo de caracteres sexuales masculinos; las afectadas presentan vagina en fondo de saco ciego, ausencia de útero, tubas uterinas y disgenesia gonadal.
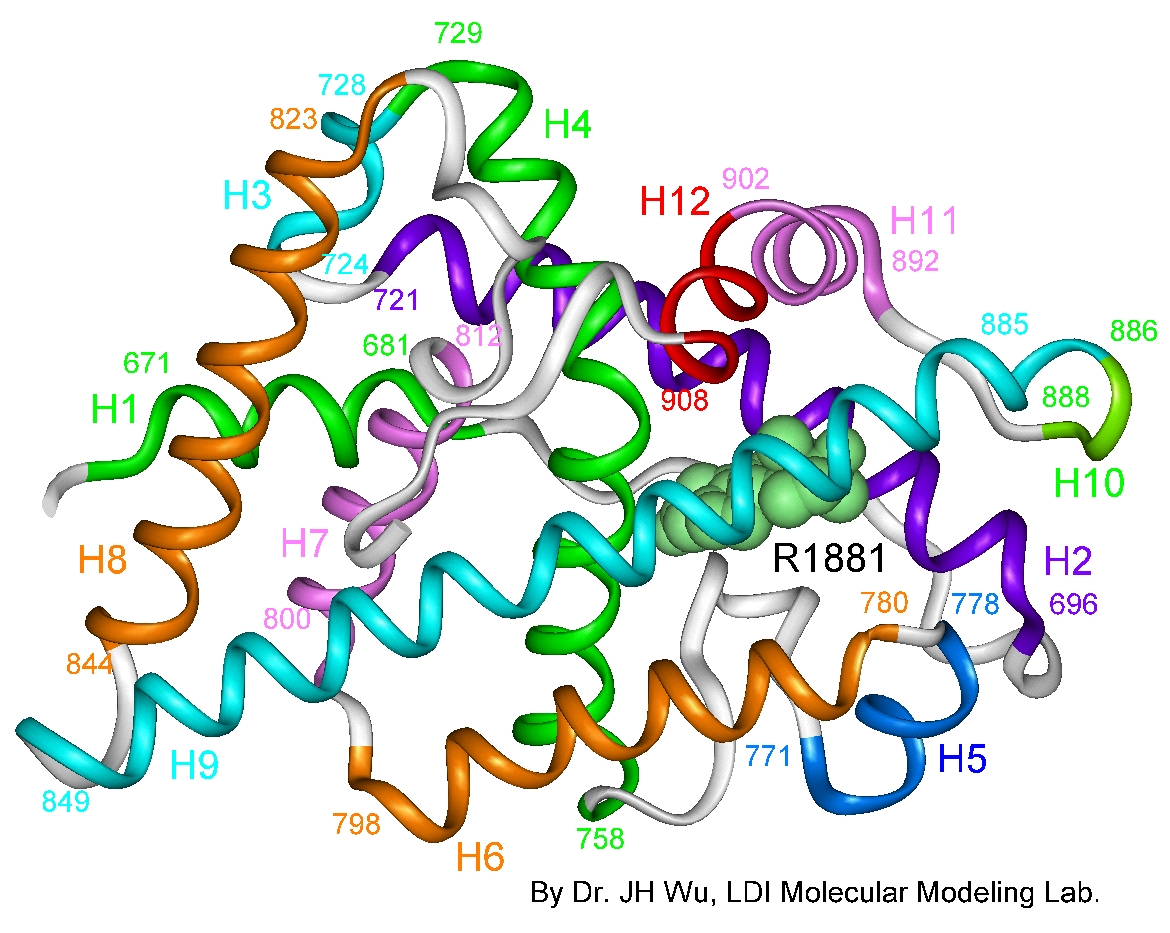
University Lady Davis Institute. (2005).
Proteína receptora de andrógenos [ilustración]. Tomada de
https://es.m.wikipedia.org/wiki/Archivo:Androgen_receptor_3-d_model.jpg
A pesar de que la genética mendeliana ofrece una visión clara a muchas enfermedades genética de tipo familiar, existen otros conceptos, a la par de ésta, que ayudan a entender la herencia de otros alelos y su expresión en el fenotipo; además de penetrancia y expresividad. Dentro de estos conceptos encontramos codominancia, pleiotropismo, heterogeneidad y mutaciones espontáneas (alteraciones de novo).
Una característica común en todos los tipos de herencia autosómica, dominante, recesiva o ligada
al sexo es que sólo uno de los dos alelos, el dominante, se manifiesta en el fenotipo. Para
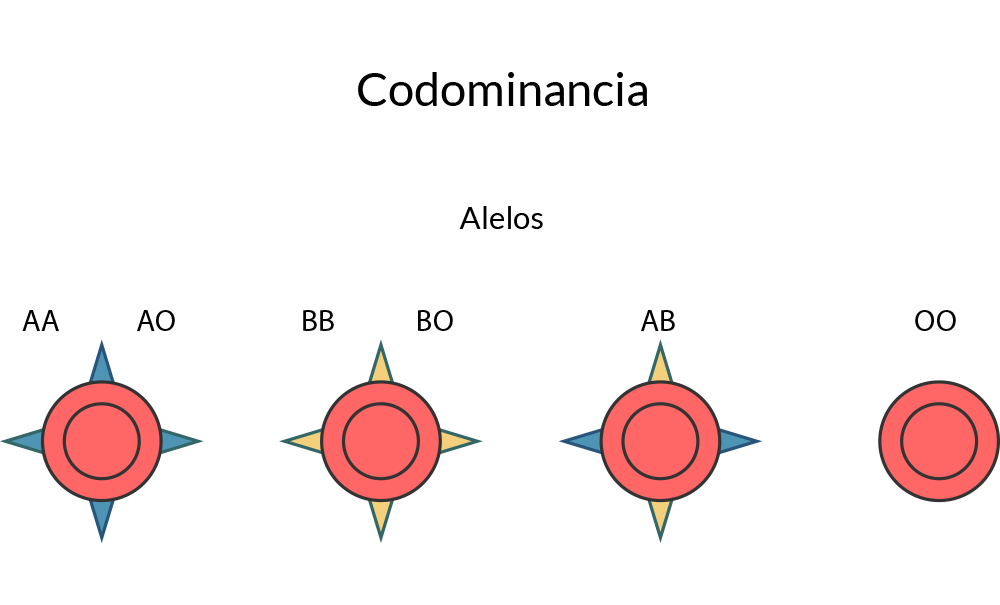
algunos rasgos, ambos alelos contribuyen de igual manera al fenotipo; un ejemplo de esto es el
tipo sanguíneo en la clasificación ABO.
En este tipo sanguíneo de este sistema es determinado por antígenos (carbohidratos) de la
membrana de los eritrocitos. El tipo de antígeno es determinado por el alelo presente para una
enzima glicosiltransferasa de membrana; esta enzima existe en tres variantes: A, B y O.
Podemos simplificar el sistema de la siguiente manera: los alelos A y B codifican para dos
antígenos diferentes, mientras que el alelo O codifica para la ausencia de algún antígeno. En
este sistema los alelos A y B son codominantes; es decir, se pueden manifestar al mismo
tiempo, dando lugar al tipo sanguíneo AB. Por otro lado, el alelo O es recesivo a los alelos A y
B. De esta forma, la relación fenotipo genotipo quedaría de la siguiente forma:
Codominancia
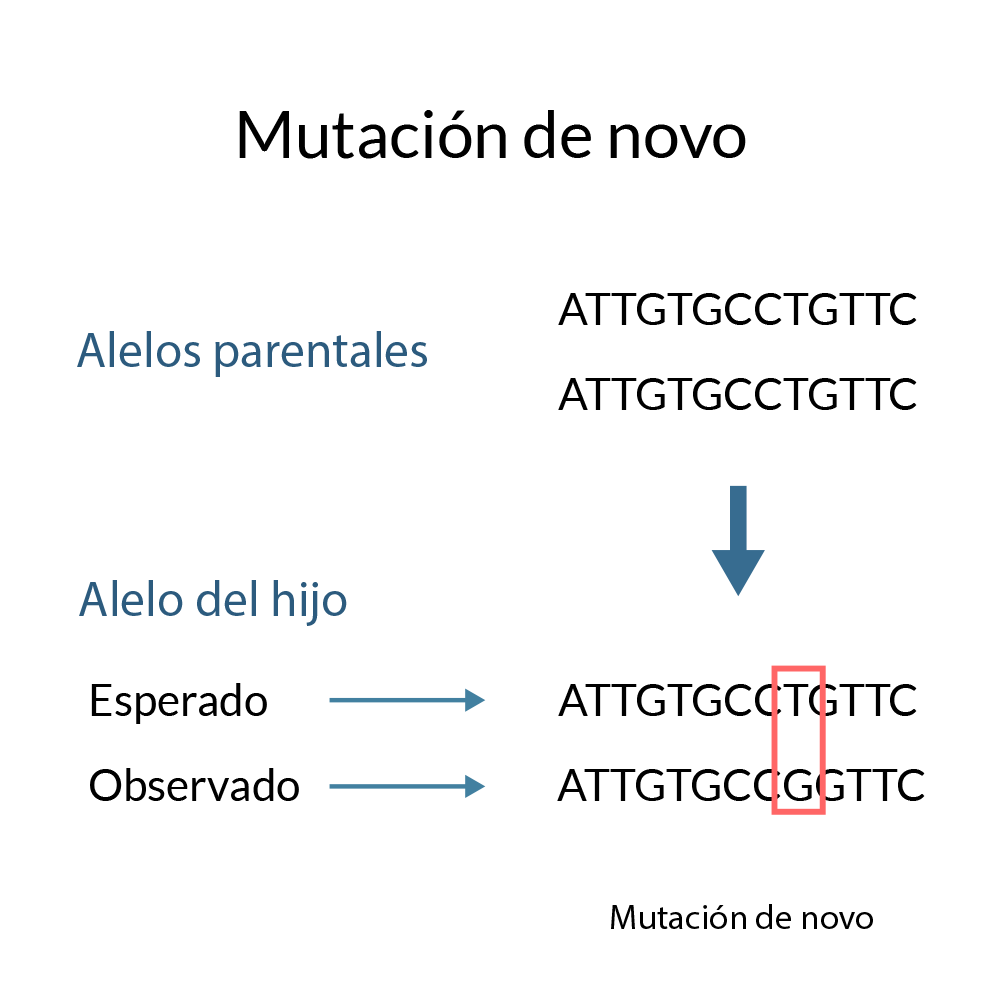
Existen casos en que algunas personas nacen con algún padecimiento, el cual no encaja en los
patrones de herencia antes mencionados, en el sentido de que ninguno de los padres es tanto
portador ni afectado. Estos casos aislados se deben a mutaciones espontáneas que aparecen
directamente en la línea germinal de uno o ambos padres. Es decir, que aparecen en las células
precursoras de los gametos; de esta manera, pueden presentarse padecimientos congénitos en un
individuo, sin que sus padres sean necesariamente afectados o portadores.
Las causas de estas mutaciones espontáneas son variadas; se encuentran asociadas de la siguiente
forma:

Mutación de novo
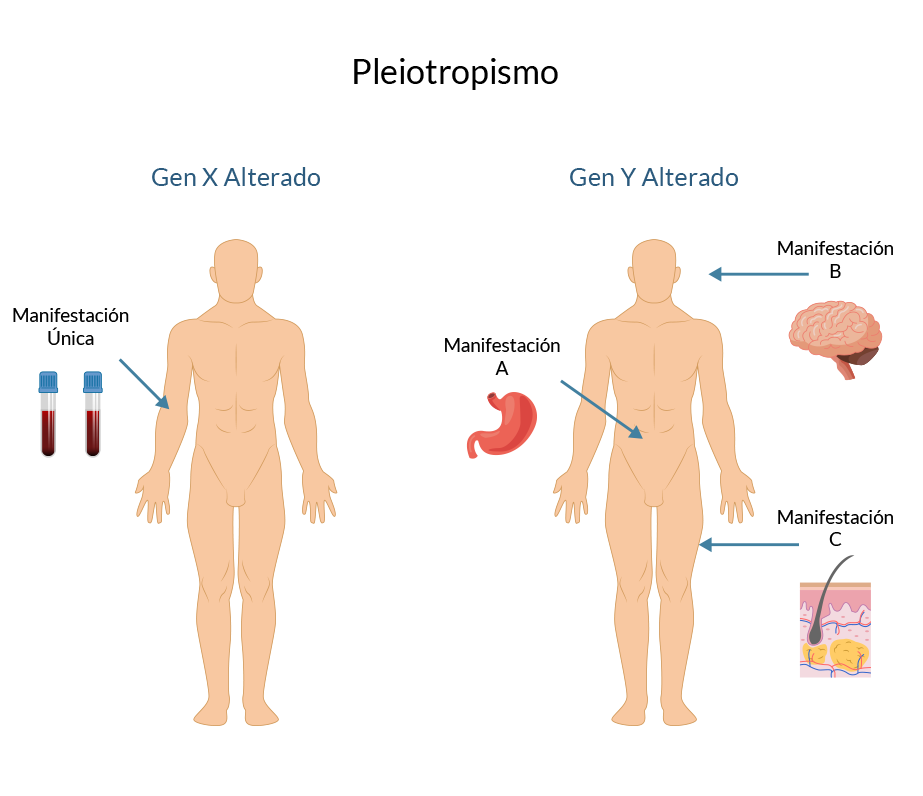
Existen enfermedades genéticas donde el defecto se presenta en un solo sistema orgánico, un ejemplo de éste es la hemofilia tipo A; sin embargo, no todas las enfermedades genéticas afectan a un sólo aparato o sistema. La mayor parte de las enfermedades monogénicas presentan múltiples efectos fenotípicos en diversos sistemas orgánicos, con la aparición de signos y síntomas en diferentes momentos de la vida, a este fenómeno lo denominamos pleiotropismo. Un caso que representa esta característica sería el de la fibrosis quística, donde no sólo se observan alteraciones a nivel de aparato respiratorio, sino que también del digestivo.
Pleiotropismo
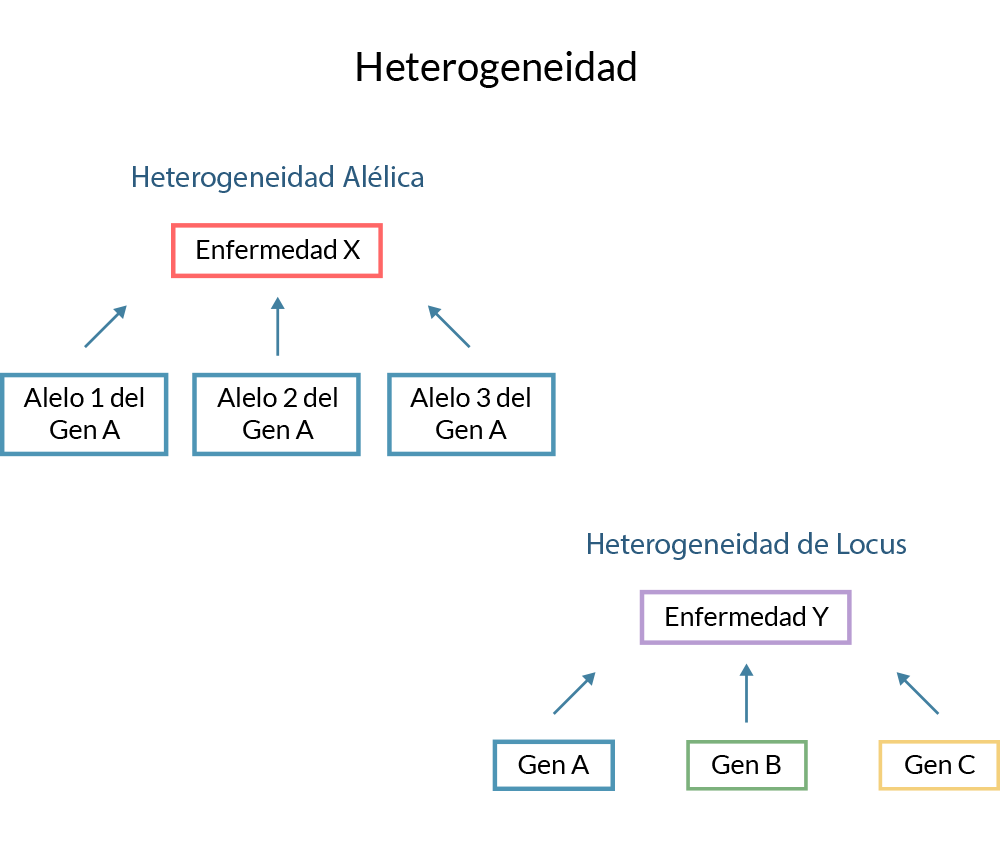
Alélica
En una población puede haber alelos mutantes diferentes para un mismo locus. Un fenotipo puede
ser causado por diferentes alelos mutantes en el locus, más que alelos idénticos del mismo
locus.
De locus
Se refiere a la producción de fenotipos idénticos por mutaciones en dos o más loci diferentes,
por ejemplo, en el síndrome de orina de jarabe de maple observamos mutaciones en diversos de los
componentes del complejo; pero se presenta la misma patología.
Heterogeneidad
Algunos de los mecanismos de herencia asociadas a herencia monogénica, pero que no siguen las reglas de herencia mendeliana son los siguientes:
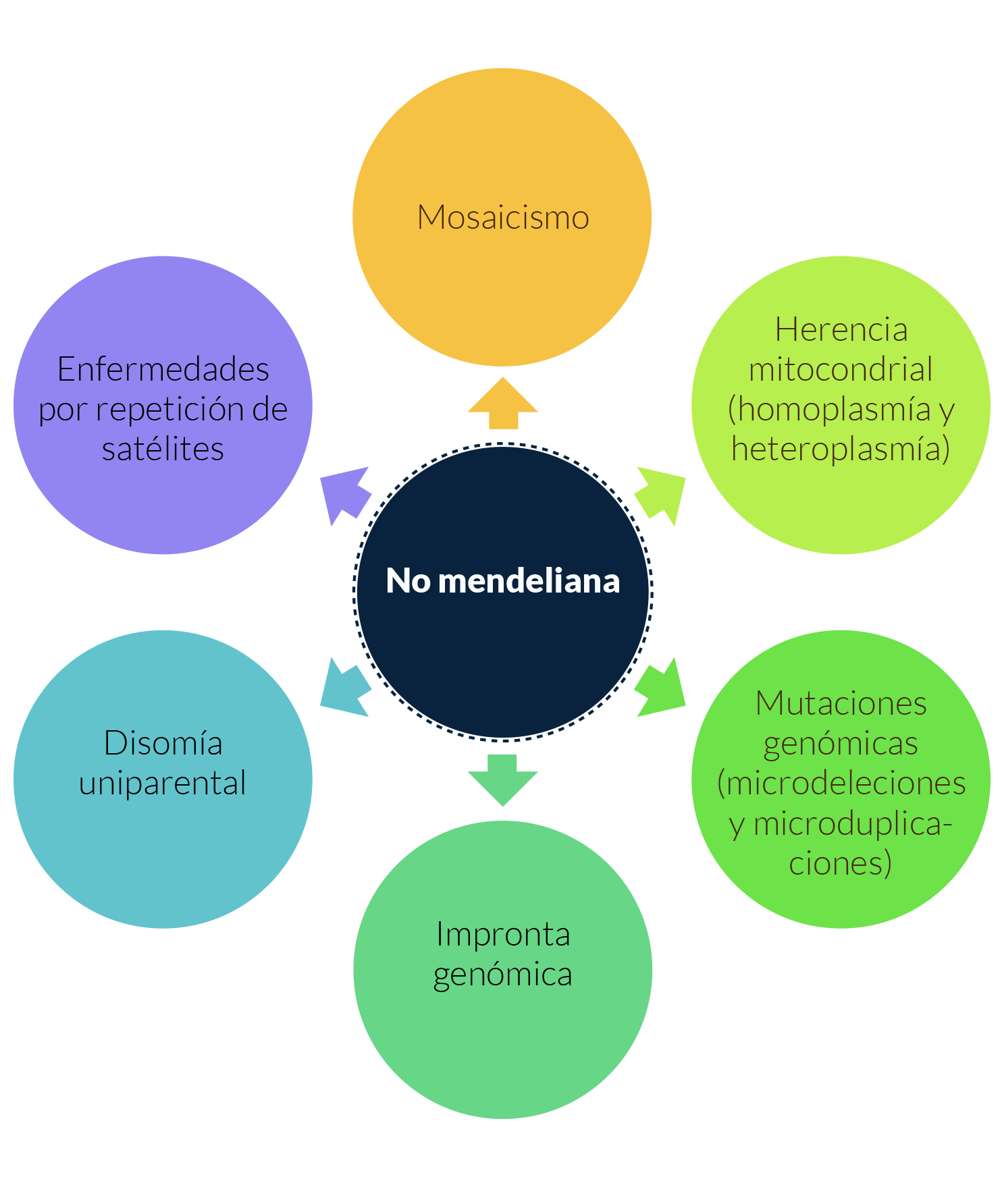
En todos los casos, anteriormente discutidos, el defecto genético está presente desde la fecundación; lo que ocasiona que todas las células que forman el organismo portan el mismo error. Sin embargo, en algunos casos, durante las primeras divisiones del embrión o del feto, algunas células pueden generar una mutación espontánea o pueden segregar sus cromosomas de manera errónea. La consecuencia directa de esto es que todas las células que desciendan de esta célula “aberrante” van a acarrear este defecto. El hecho de que una sola célula genere un error podría parecer inofensivo; no obstante, debemos recordar que, durante las etapas embrionarias y fetales, el producto se encuentra en proliferación celular constante. Debido a esto, una sola célula puede generar una gran descendencia
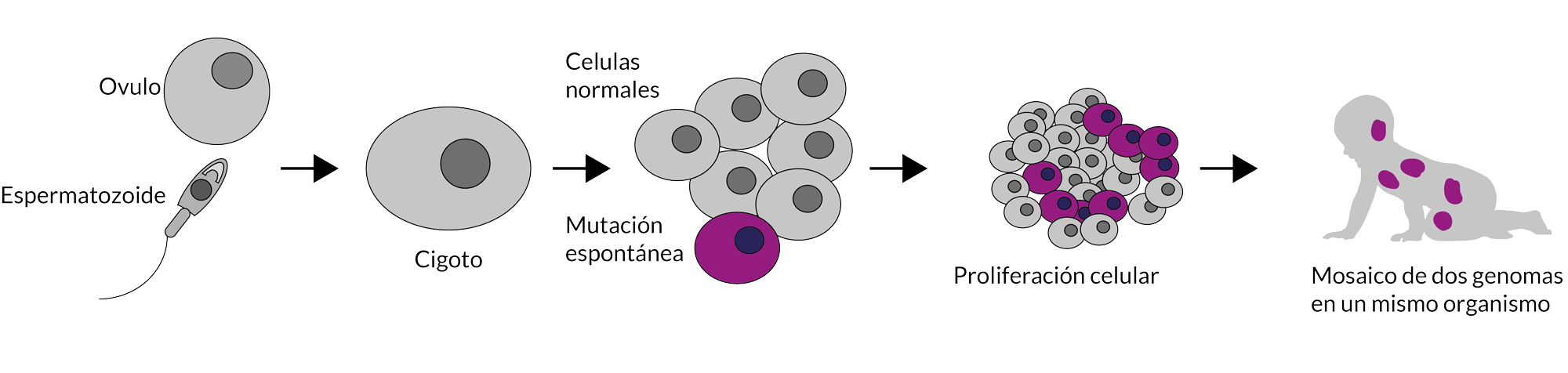
Mosaicismo
En conclusión, las enfermedades genéticas son causadas por errores en la secuencia genética de uno o varios genes, dependiendo de su ubicación en el genoma; cada uno de estos desordenes tendrá un tipo o patrón de herencia característico. El identificar las características básicas de los diferentes tipos de herencia es de gran utilidad para el médico general y, sobre todo, para el genetista; no necesariamente para realizar un diagnóstico o tratamiento, sino para poder dar un adecuado asesoramiento genético a padres con antecedentes familiares o personales de alguna alteración genética.
Resulta interesante para las personas, pero sobre todo útil para el médico general y el estudiante de medicina, identificar las principales alteraciones genéticas para poderlas derivar al siguiente nivel de atención.
Además de esto, debe ser consciente del tipo de herencia que pueden presentar éstas cuando realice la historia clínica, para que sean tratadas de manera oportuna.
Como parte de su formación profesional, por el departamento de genética, en donde aprende a tratar con pacientes con diversas alteraciones genéticas, uno de los puntos clave en este nivel de atención es el diagnóstico y confirmación, de manera oportuna, para poder brindar el tratamiento adecuado; sin embargo, la función central de esta atención es el asesoramiento genético y reproductivo.
El médico general debe ser capaz de identificar las alteraciones genéticas más frecuentes para poder derivar a los pacientes al siguiente nivel de atención. Además de esto, debe ser consciente del tipo de herencia que pueden presentar éstas, cuando elabore la historia clínica para realizar la sospecha diagnóstica de éstas, de manera oportuna.
Como parte de su formación profesional, usted realiza una rotación por el departamento de
genética de hospitales de segundo y tercer nivel, en estos niveles aprende el abordaje que
debe tener el paciente con alteraciones genéticas.
Una de las principales funciones de este nivel de atención es el diagnóstico y confirmación,
de manera oportuna, para poder brindar el tratamiento adecuado; sin embargo, la otra función
clave es el asesoramiento genético y reproductivo, tanto a los pacientes como a las
familias.
Bibliografía
Thompson y Thompson. (2017). Genética médica (8.ª ed.). Nussbaum, McInnes: Willard.
Sitios electrónicos
Online Mendelian Inheritance in Man. (s. f.). An Online Catalog of Human Genes and Genetic
Disorders. Consultado de https://www.omim.org/
US National Library of Medicine National Institutes of Health. (s. f.). Artículos de la red
de Pubmed. Consultados de https://www.ncbi.nlm.nih.gov/pubmed/
Cómo citar
Escalona, J., Sánchez, M. y De Ita, M. (2018). Fundamentos de la herencia mendeliana. Unidades de Apoyo para el Aprendizaje. CUAED/Facultad de Medicina-UNAM. Consultado el (fecha) de (vínculo)