En los sistemas biológicos, pequeños cambios del pH pueden tener efectos significativos en el funcionamiento celular, por lo cual la regulación del estado ácido-base está fuertemente controlada. En esta UAPA, se explora la fisiología de la regulación ácido-base, examinando los sistemas amortiguadores químicos, la regulación respiratoria y renal como principales mecanismos para controlar cambios en el pH. De igual forma, se comentan brevemente manifestaciones clínicas y trastornos asociados a alteraciones en el estado ácido-base.
Fisiología de la regulación ácido-base
El estado ácido-base es regulado por tres mecanismos principales que actúan en diferentes momentos de tiempo:

A continuación, se explicará el concepto de amortiguadores químicos; posteriormente, se examinará el papel de cada uno de los mecanismos involucrados en la regulación ácido-base.
Amortiguadores ácido-base
Los amortiguadores ácido-base representan sistemas químicos que tienen un ácido débil que cede protones y su base conjugada que acepta. Su principal función es compensar rápidamente cambios en el pH.
En caso de que sea introducido un ácido al sistema, la base acepta los protones extras, neutralizando el ácido con un ligero cambio del pH. Por el contrario, en caso de que sea establecida una base al sistema, el ácido cede su protón y neutraliza la base. En ambos casos, únicamente cambia la razón entre la concentración del ácido y la base, con ligeras modificaciones del pH.
La capacidad de los amortiguadores para evitar cambios significativos de pH es máxima cuando éste es igual al pKa. El pKa representa el pH en el cual las concentraciones de ácido y base conjugadas son iguales. Por lo tanto, la concentración de ácido y base deben ser muy similares para que el sistema funcione. De manera general, un ácido débil tiene utilidad como amortiguador si se encuentra en un rango ±1 pH de su pKa.
Existen dos amortiguadores principales en el cuerpo humano, los cuales se encuentran cada uno en compartimientos diferentes; por un lado, el sistema amortiguador fosfato; por el otro, el sistema amortiguador bicarbonato (HCO3–):
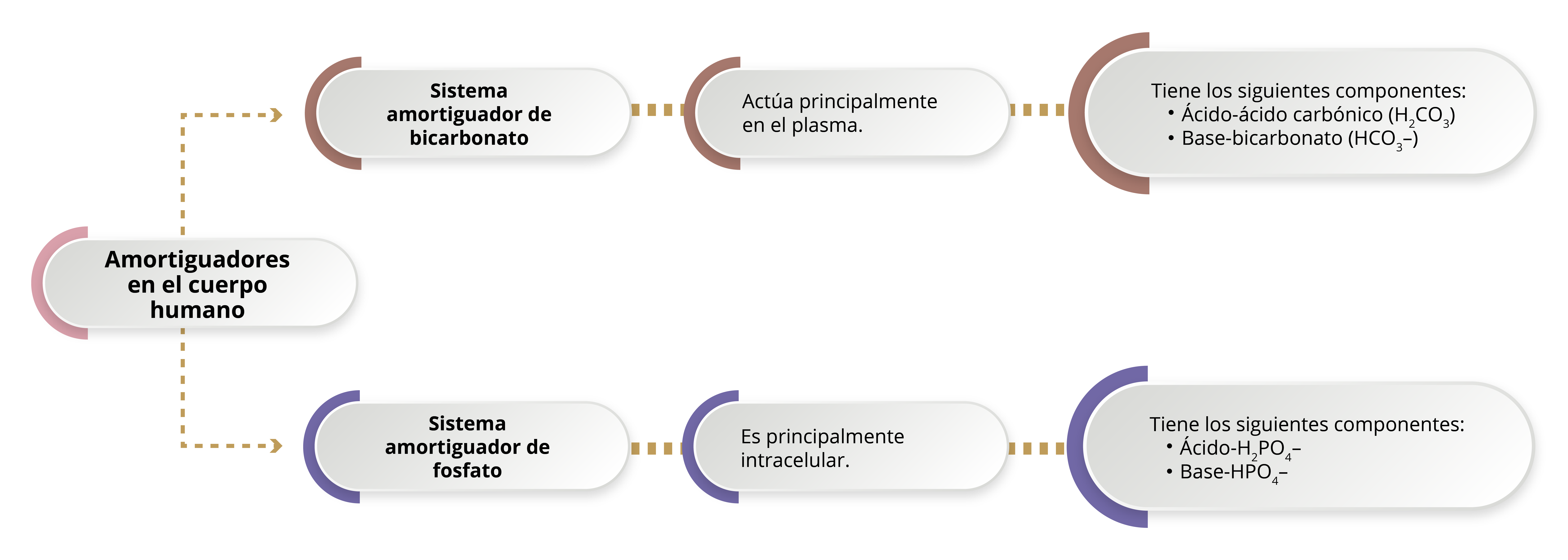
Es el principal responsable de la regulación ácido-base en el plasma y se basa en la siguiente reacción:
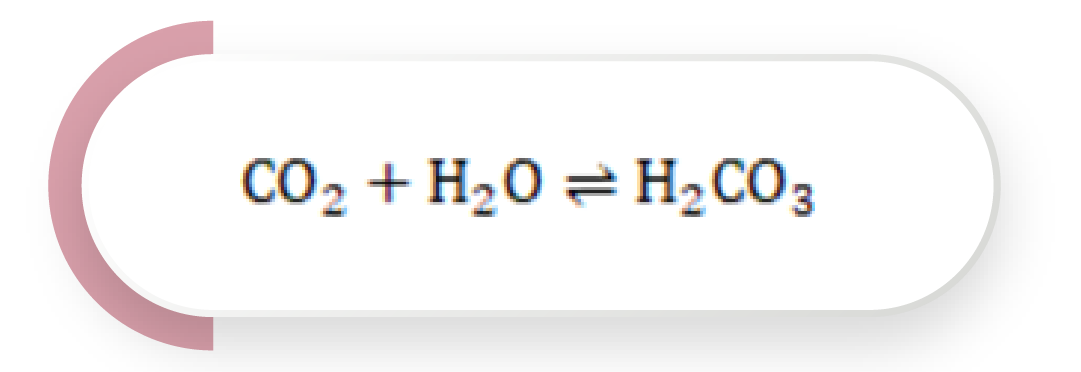
Ecuación 1
Esta reacción no es veloz y requiere la acción enzimática de la anhidrasa carbónica. Por otra parte, el ácido carbónico (H2CO3) puede, a su vez, ionizarse y generar:
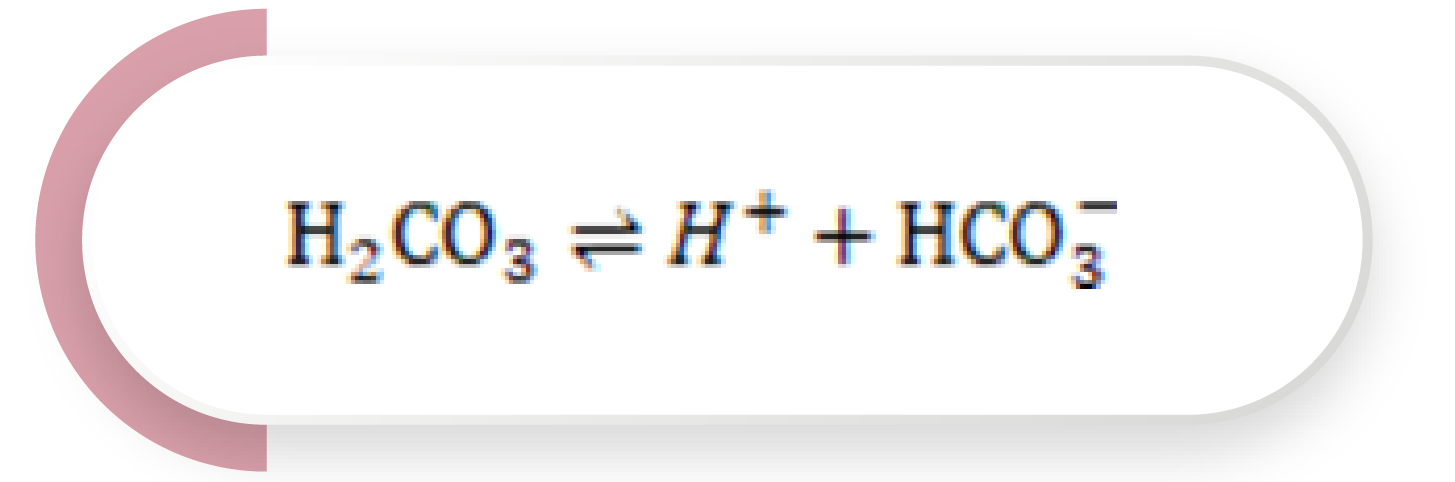
Ecuación 2
Sin embargo, la disociación del H2CO3 es débil y favorece la reacción hacia la izquierda. La adición de un ácido es amortiguada por el HCO3–, formando H2CO3, el cual, a su vez, se disocia en dióxido de carbono (CO2) y agua. El exceso de CO2 es entonces eliminado a través de la respiración, neutralizando el ácido, con pocos cambios en el pH plasmático:
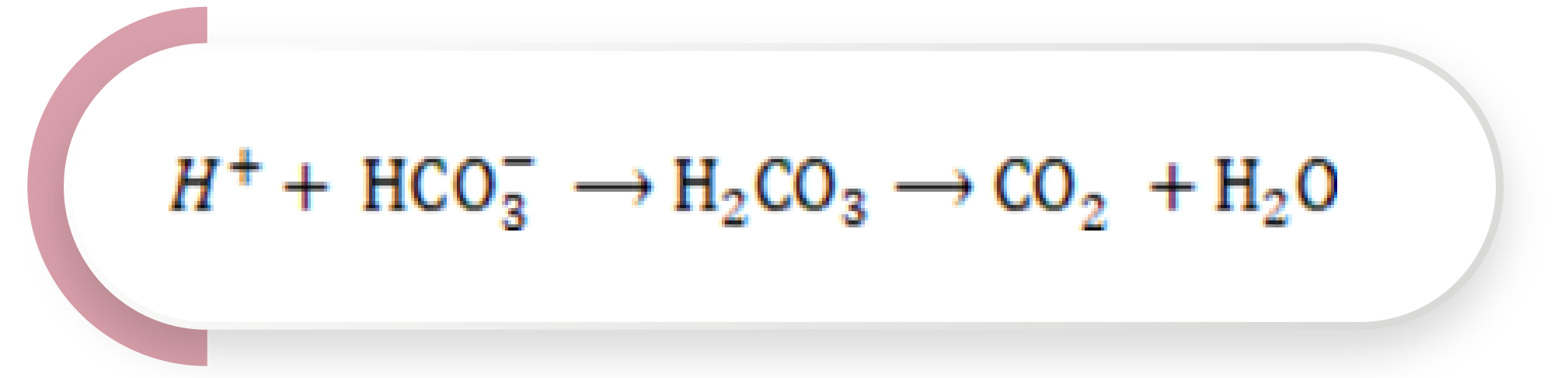
Ecuación 3
La adición de una base es amortiguada por el H2CO3, formando HCO3– y agua. El exceso de bicarbonato es eliminado posteriormente de manera renal:
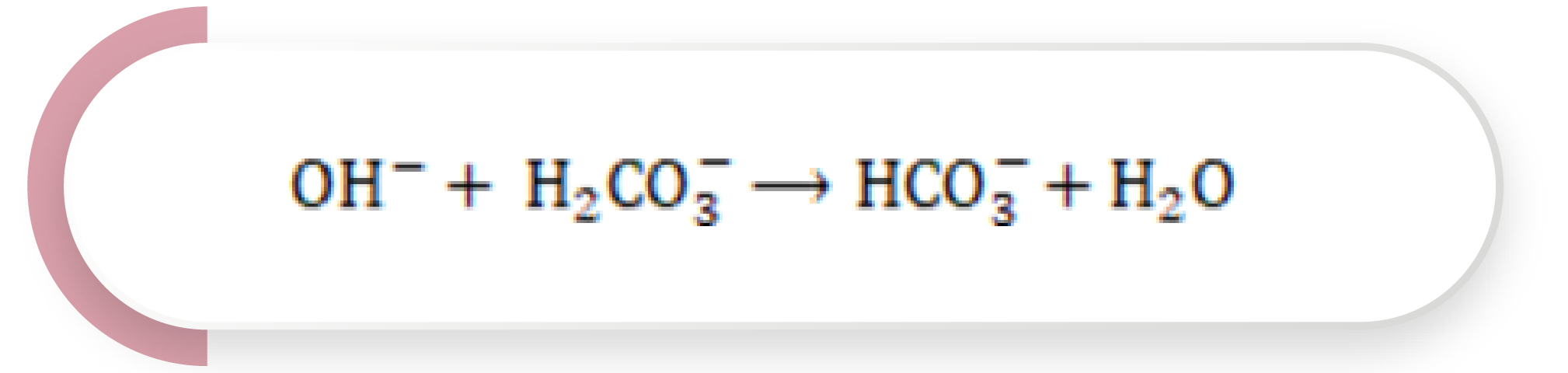
Ecuación 4
Esto tiene implicaciones clínicas, ya que conocer la concentración de HCO3– y H2CO3 nos permite saber el pH plasmático, aplicando la ecuación de Henderson-Hasselbalch; sin embargo, antes de poder calcularlo, se debe tomar en cuenta que la concentración de H2CO3 no es fácilmente medible, ya que se disocia rápidamente. Debido a que el CO2 es directamente proporcional a la concentración de H2CO3, puede utilizarse la de CO2 para el cálculo. Los laboratorios clínicos miden la presión parcial de CO2 (pCO2), no su concentración directa. Para superar este problema, simplemente se multiplica la pCO2 por el coeficiente de solubilidad del CO2, que es de 0.03 mmol/mmHg. De esta forma, la ecuación de Henderson-Hasselbalch para el cálculo del pH plasmático queda de la siguiente manera:
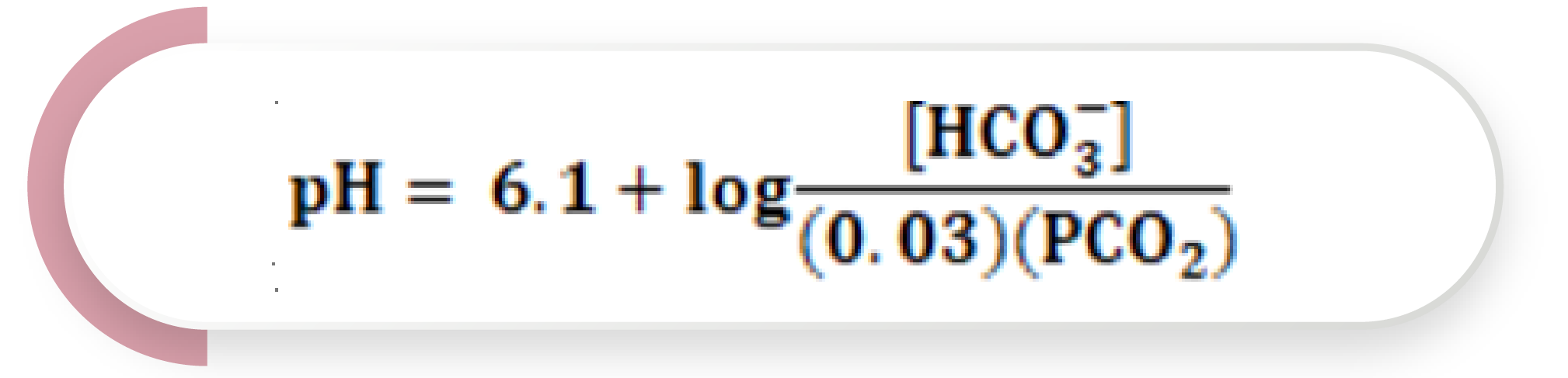
Ecuación 5
El valor de pKa del sistema de HCO3– es de 6.1, por lo cual en la ecuación 5 se ha sustituido este valor y es posible determinar el pH sanguíneo.
Este sistema tiene un papel importante en la regulación ácido-base de manera intracelular y en los túbulos renales; posee un pKa de 6.8. La adición de un ácido genera la siguiente reacción, donde la base se convierte en el ácido fosfato de dihidrógeno (H2PO4–):
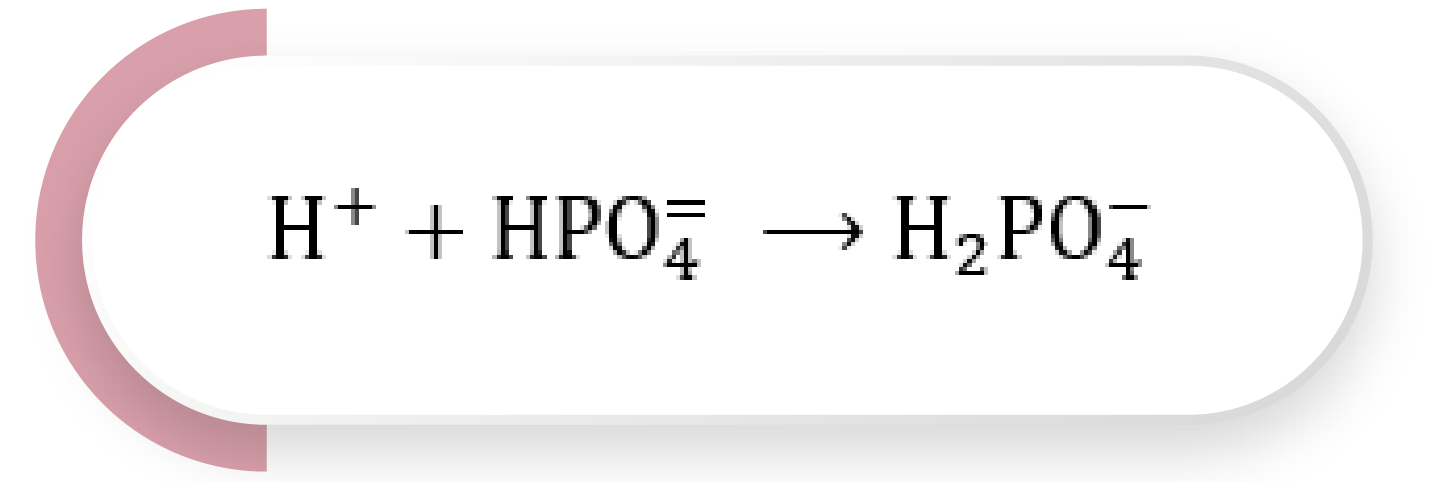
Ecuación 6
Por otra parte, la adición de una base genera que el ácido se convierta en la base HPO4= más agua:
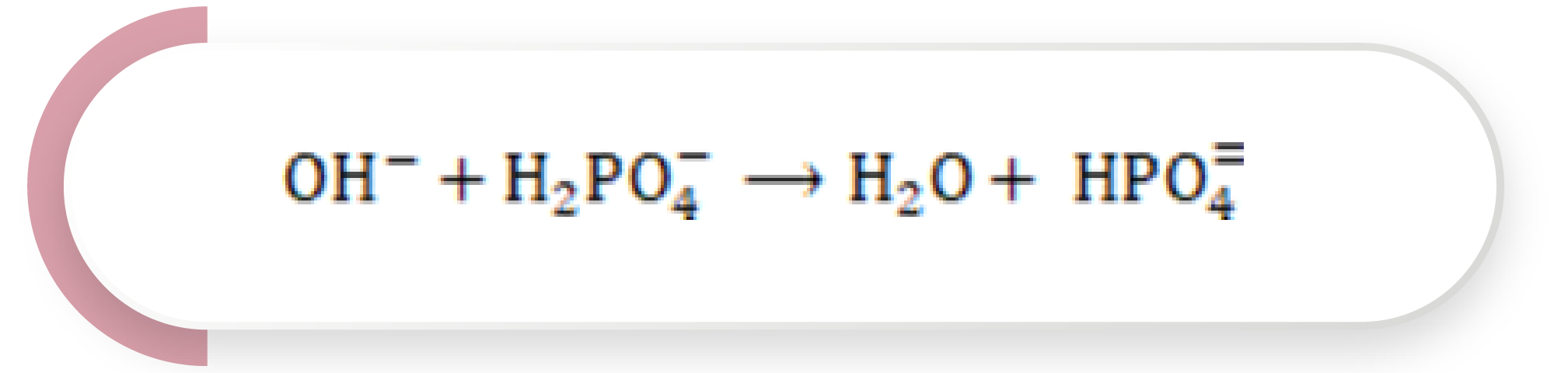
Ecuación 7
Una vez revisada la regulación del pH por parte de los amortiguadores, procederemos a revisar la regulación de éste por el sistema respiratorio.
Como se ha mencionado antes, el CO2 tiene un papel en la regulación del pH plasmático; asimismo, es producido por el metabolismo celular y su forma de eliminación es a través de los pulmones y la respiración. Mientras menor sea la ventilación, los niveles de pCO2 aumentan, con lo que se incrementan también los niveles de H2CO3, como se ha visto en la reacción 1, con lo que se disminuye el pH plasmático. Por el contrario, mientras mayor sea la ventilación, la pCO2 se reduce y genera que la reacción se dirija hacia la izquierda, lo que eleva el pH.
El pH plasmático también influye sobre el centro respiratorio. En caso de existir pH bajo, la ventilación aumenta, en un intento por eliminar CO2 excesivo y disminuir la concentración de protones. Por el contrario, si el pH plasmático está elevado, la ventilación disminuye para aumentar los niveles de hidrogeniones (H+) en sangre (figura 1).
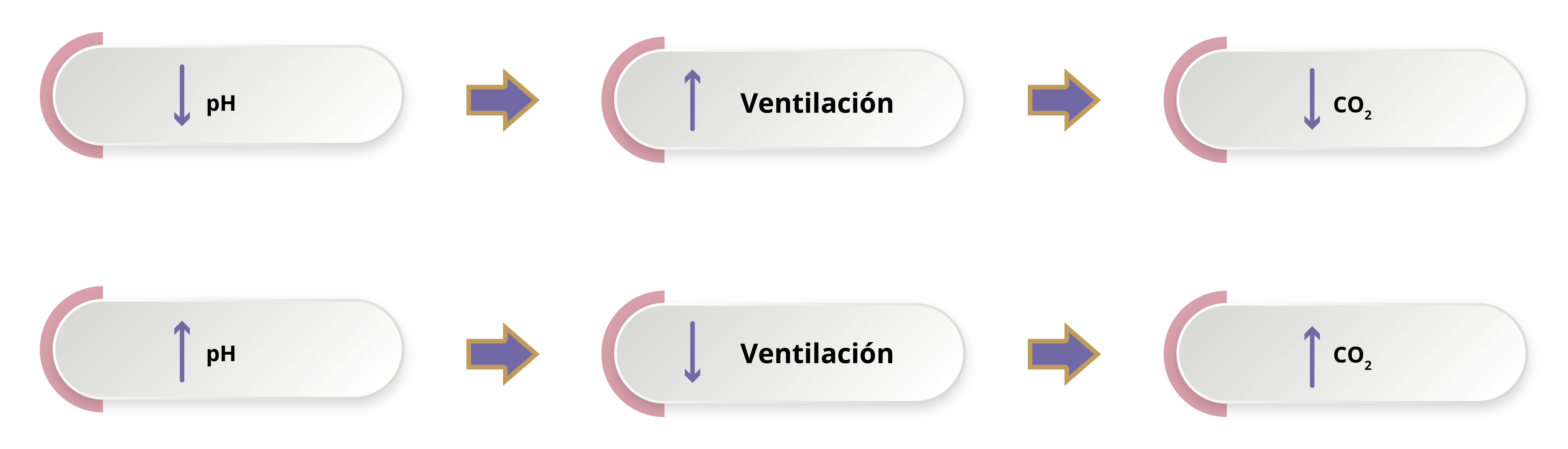
Figura 1. Influencia del pH sobre la ventilación
Una vez revisada la regulación del pH por parte del sistema respiratorio, revisaremos la regulación de éste por el riñón.
El riñón es capaz de eliminar tanto HCO3– como H+, así como de generar moléculas de HCO3–, con lo que la orina se hace ácida o básica. Los iones H+ son secretados a la luz tubular de manera activa. Una vez en la luz, el H+ interacciona con el HCO3–, formando H2CO3, el cual se disocia en CO2 y agua. El CO2 se difunde a través de la membrana tubular y, mediante la anhidrasa carbónica, es convertido nuevamente en el HCO3–, logrando así la reabsorción de bicarbonato y la eliminación de H+; es decir, por cada H+ secretado, se reabsorbe un HCO3– (figura 2).
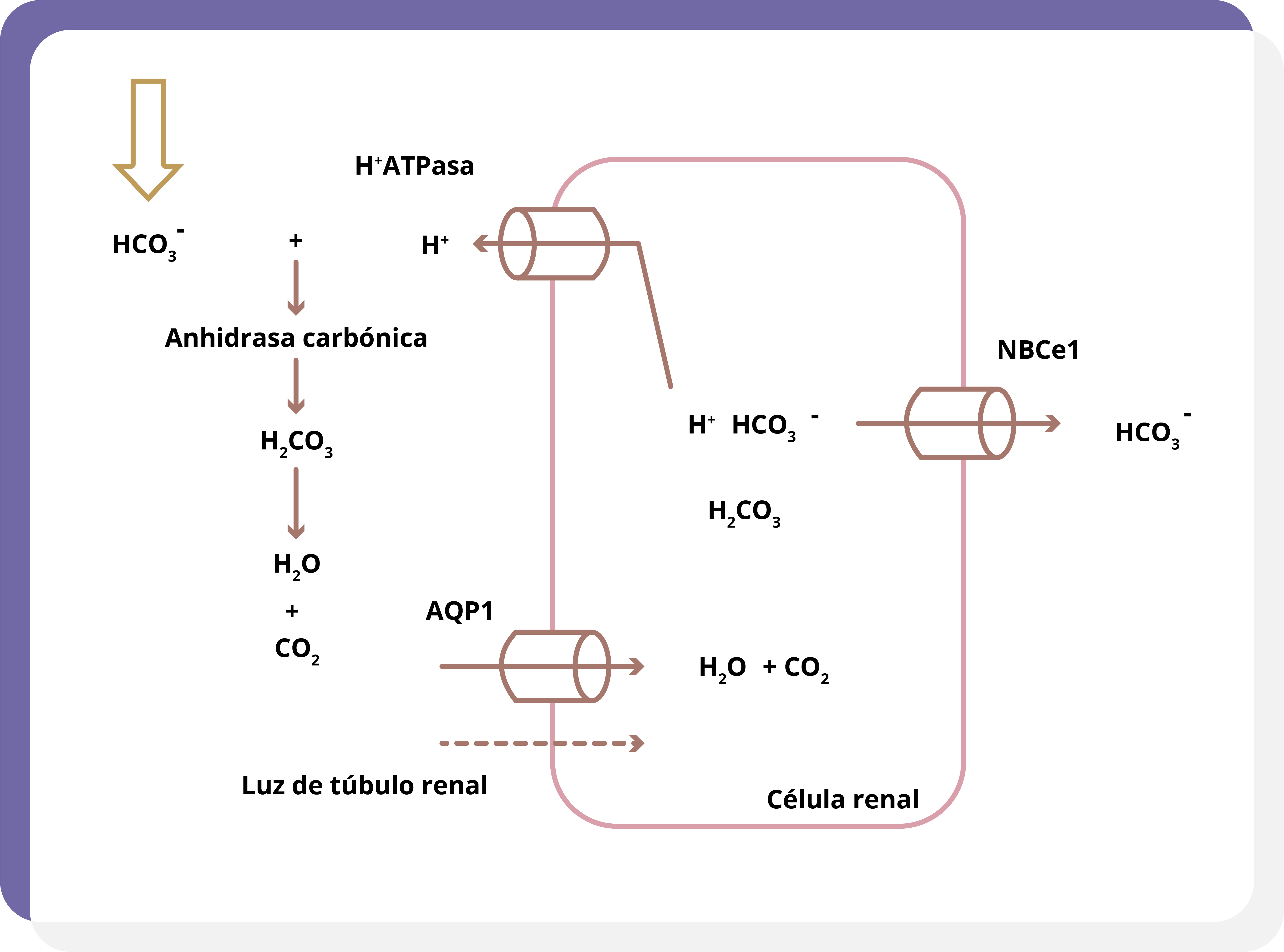
Figura 2. Los iones H+ son excretados hacia la luz tubular e interaccionan con HCO3-. Mediante la anhidrasa carbónica, se produce H2CO3, que se disocia a H2O y CO2. El CO2 se difunde por la membrana celular y el agua atraviesa la misma a través de la acuaporina 1 (AQP1). Ya en la célula renal, el H2O y el CO2 interaccionan nuevamente y se forma H+ y HCO3-. De esta forma, por cada H+ secretado, se reabsorbe una molécula de HCO3-.
En caso de existir un exceso plasmático de HCO3–, se filtra hacia los túbulos renales, donde no se logra su reabsorción completa y es excretado, facilitando la corrección del trastorno ácido-base (figura 3).
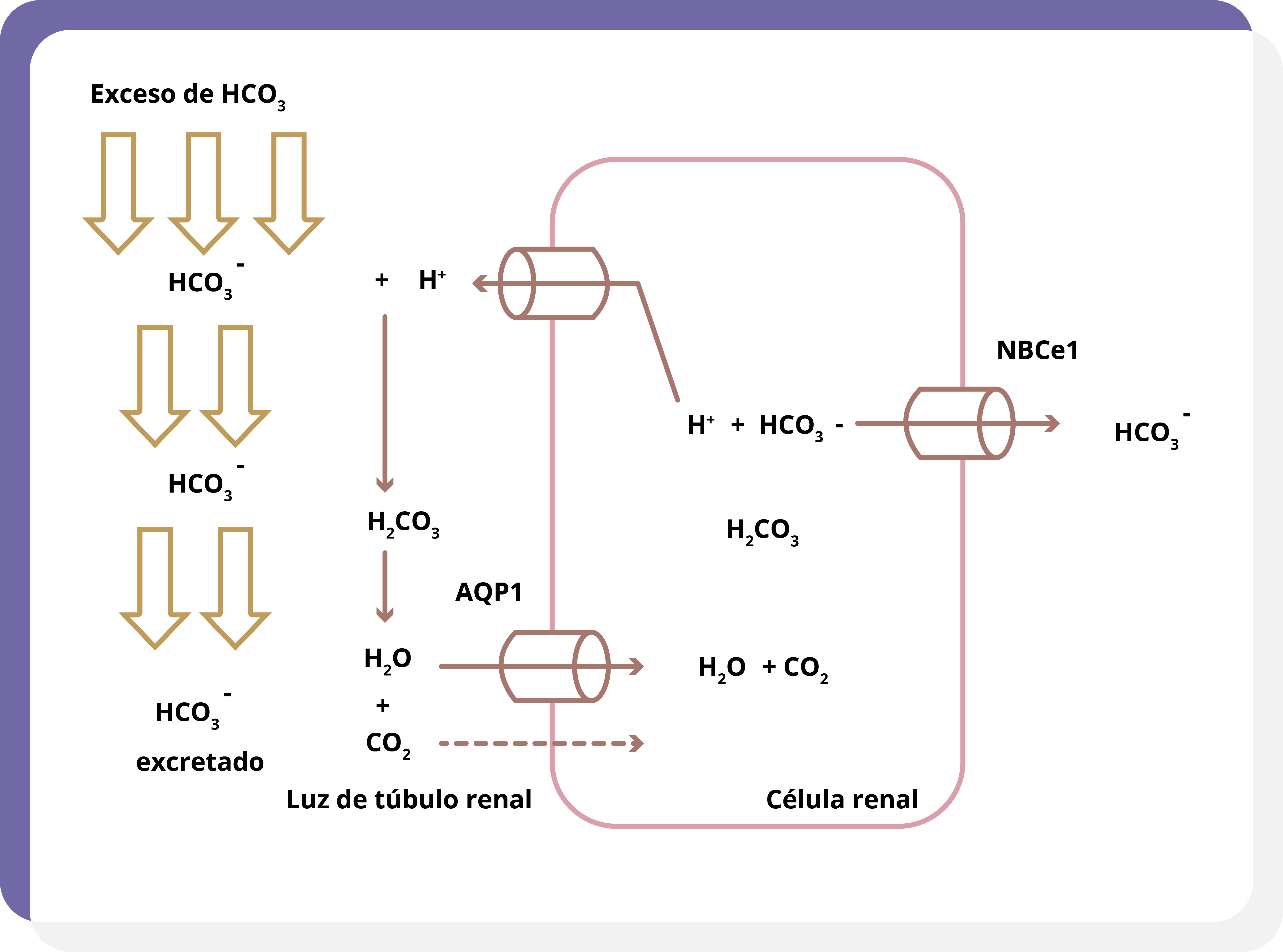
Figura 3. Ante un exceso de HCO3-, no se logra la reabsorción completa del mismo y el resto se excreta.
En caso de existir un exceso plasmático de H+, se filtra hacia los túbulos renales, donde se da la reabsorción completa de HCO3- y el exceso de protones es excretado (figura 4).
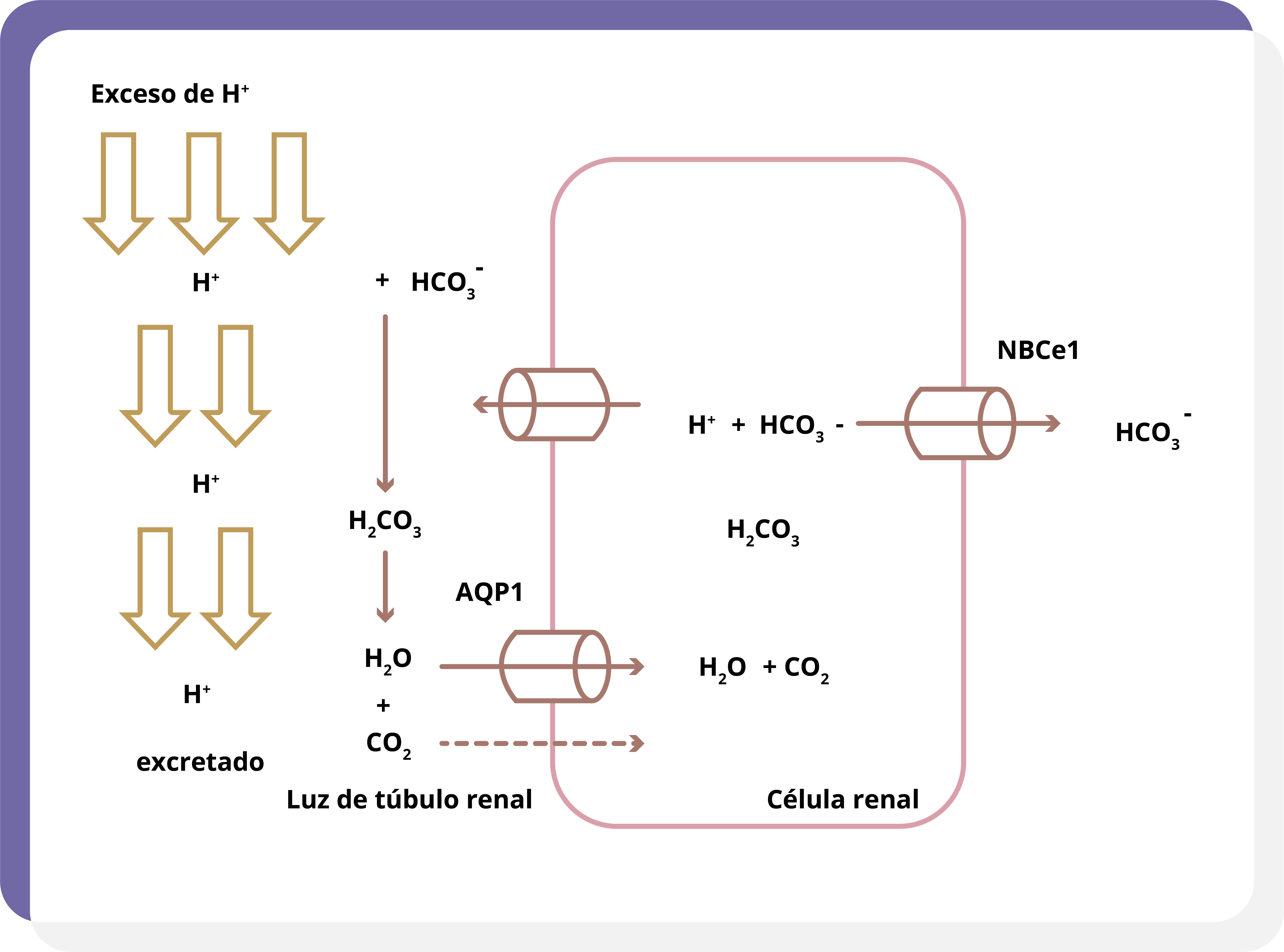
Figura 4. Ante un exceso de H+, todo el HCO3- es reabsorbido mediante el mecanismo ya descrito y el resto de H+ es excretado.
Finalmente, existe un último mecanismo que ocurre en la porción final del túbulo distal y colector. Éste se da cuando el CO2 plasmático se difunde a través de la membrana basolateral de la célula intercalada, donde es convertido a HCO3– y H+. El bicarbonato es reabsorbido al plasma y el H+ es excretado mediante transporte activo hacia el túbulo renal (figura 5).
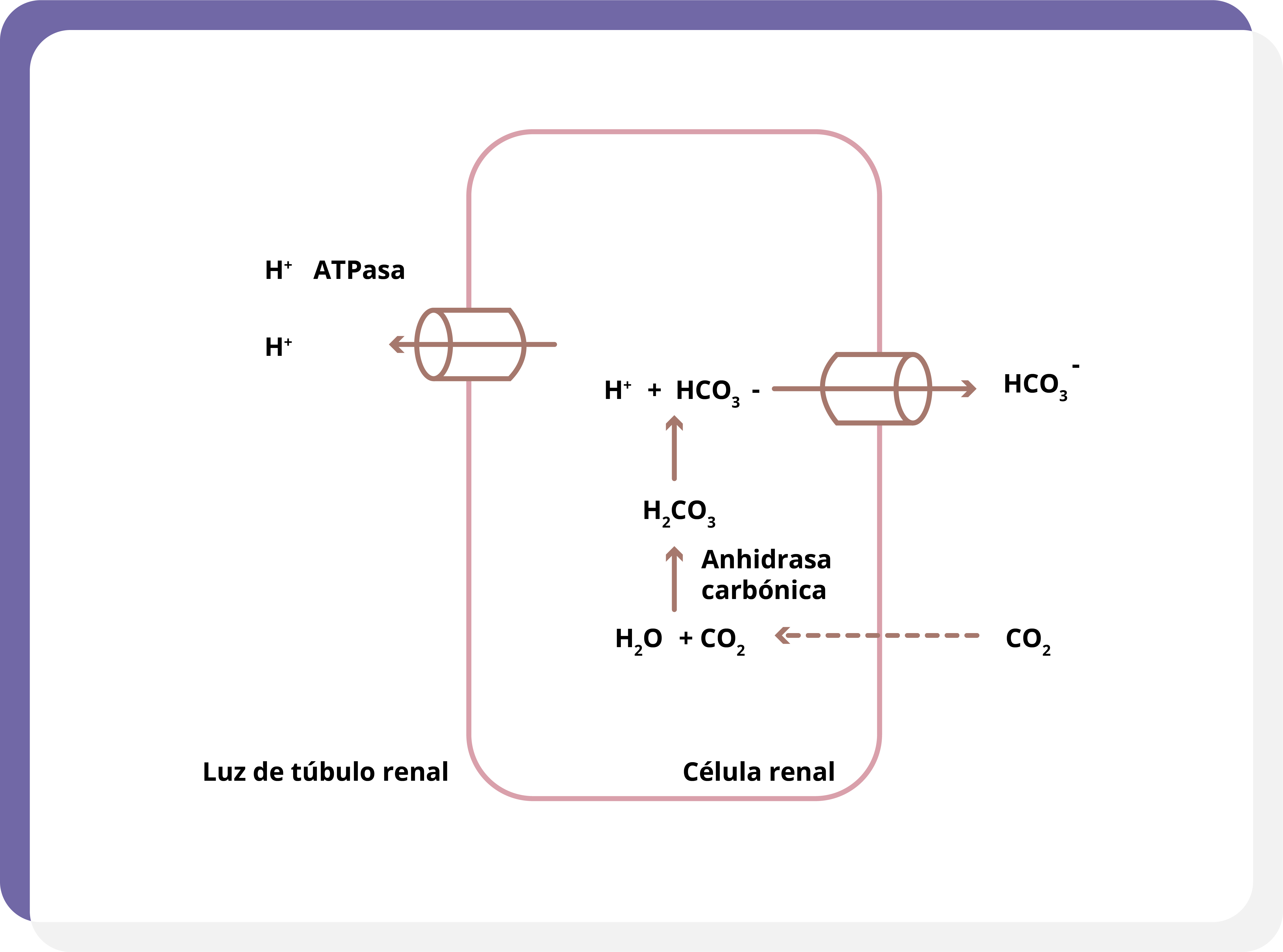
Figura 5. En el túbulo distal y colector, el CO2 se difunde por la membrana basolateral de las células intercaladas. Éste se convierte en H2CO3 que, a su vez, se disocia en H+ y HCO3-. El H+ es secretado, entonces, mediante transporte activo hacia la luz tubular.
Ahora que hemos revisado los principales mecanismos que se ven involucrados en la regulación ácido-base, abordaremos la aplicación clínica de estos conceptos en los trastornos respectivos y la cetoacidosis diabética.
El pH plasmático oscila entre los 7.35-7.45. Cuando este valor se encuentra por debajo de 7.35, existe un estado patológico conocido como acidemia; si el valor se encuentra por arriba de 7.45, se dice, entonces, que hay alcalemia.
Si la acidemia se presenta con manifestaciones clínicas, existe acidosis; por otra parte, si la alcalemia se presenta con manifestaciones clínicas, hay alcalosis. En la tabla 1, se muestran causas de acidosis y alcalosis (Kaufman, s. f.), mientras que, en la tabla 2, se resumen las manifestaciones clínicas de estos dos trastornos ácido-base.
| Acidosis metabólica | Alcalosis metabólica |
| Cetoacidosis diabética y alcohólica, acidosis láctica, intoxicación con etanol, metanol, salicilatos o isoniazida | Vómito intenso, uso de diuréticos de asa o tiazídicos, insuficiencia cardiaca, cirrosis |
| Acidosis respiratoria | Alcalosis respiratoria |
| Asma, enfermedad pulmonar obstructiva crónica (EPOC), depresión respiratoria, apnea obstructiva del sueño, alteraciones neuromusculares | Fiebre, ansiedad, edema cerebral y pulmonar, derrame pleural, neumonía |
Tabla 1. Causas de trastornos ácido-base
| Acidosis | Alcalosis |
| Hiperventilación | Hipoventilación-hipoxemia |
| Fatiga de músculos respiratorios —uso de músculos accesorios— | Arritmias |
| Contractilidad miocárdica deprimida | Tetania |
| Hiperactividad simpática | Crisis convulsivas |
| Resistencia a la insulina —hiperglucemia— | Letargo |
| Hipercalemia | Delirio |
| Apatía, estupor o coma | Estupor |
| Hipocalemia-hipocalcemia | |
| Hipomagnesemia-hipofosfatemia |
Tabla 2. (s. a.) (2023). Manifestaciones clínicas de trastornos ácido-base [tabla]. Basada en Carrillo, R. (2008). Clínicas Mexicanas de Anestesiología. Clínica de líquidos y electrolitos, p. 6.
La determinación de gases arteriales constituye el estándar de oro para el diagnóstico del desequilibrio ácido-base. Para la toma de la muestra se utiliza una jeringa bañada con heparina y se opta por la arteria radial. La muestra se envía a laboratorio y, en minutos, se obtienen los resultados. Los valores de referencia en la Ciudad de México se muestran en la tabla 3:
| Arteria | Vena | Unidad | |
| Presión parcial de oxígeno (PaO2) | 60-80 | 35-45 | mmHg |
| pH | 7.35-7.45 | 7.32-7.38 | |
| pCO2 | 28-32 | 32-36 | mmHg |
| HCO3- | 18-22 | 17-20 | mmol/l (mEq/l) |
| Saturación de oxígeno (SatO2) | 90-100 | 60-70 | % |
Tabla 3. (s. a.) (2023). Valores normales de gasometría arterial [tabla]. Basada en Carrillo, R. (2008). Clínicas Mexicanas de Anestesiología. Clínica de líquidos y electrolitos, p. 7.
Una vez que se tengan los resultados, se recomienda analizar en el orden que muestra la tabla 4:
| Oxigenación (PaO2 y SatO2) | Ácido-base (pH) | Respiratorio (pCO2) | HCO3 | |
| Arriba | Hiperoxemia | Alcalosis | Hipercapnia-hipoventilación | Hiperbasemia |
| Normal | Normoxemia | Eudremia | Normocapnia-normoventilación | Normobasemia |
| Debajo | Hipoxemia | Acidosis | Hipocapnia-hiperventilación | Hipobasemia |
Tabla 4. (s. a.) (2023). Resultados de gasometría [tabla]. Basada en Carrillo, R. (2008). Clínicas Mexicanas de Anestesiología. Clínica de líquidos y electrolitos, p. 8.
Mediante la combinación de pH, pCO2 y HCO3, se diagnostica el trastorno primario, tal como se muestra en la tabla 5:
| Trastorno | Anormalidad primaria | Respuesta secundaria |
| Acidosis metabólica | •Ganancia de H+ •Pérdida de HCO3 |
Hiperventilación |
| Alcalosis metabólica |
•Ganancia de HCO3 •Pérdida de H+ |
Hipoventilación |
| Acidosis respiratoria | Hipoventilación | Retención de HCO3 |
| Alcalosis respiratoria | Hiperventilación | Eliminación de HCO3 |
Tabla 5. (s. a.) (2023). Trastornos primarios ácido-base [tabla]. Basada en Carrillo, R. (2008). Clínicas Mexicanas de Anestesiología. Clínica de líquidos y electrolitos, p. 8.
Si la respuesta secundaria se encuentra en los rangos esperados, se habla de un trastorno ácido-base puro; si no es así, se habla de un trastorno mixto.
Cetoacidosis diabética
Uno de los principales trastornos ácido-base que se encuentran en la práctica clínica es la cetoacidosis diabética. La diabetes mellitus es una enfermedad caracterizada por deficiencia de insulina, ya sea total —tipo 1— o parcial —tipo 2—. En condiciones normales, después de ingerir alimentos, se libera insulina, cuya función principal es facilitar la introducción de glucosa a las células periféricas, especialmente adipocitos y células de músculo esquelético.
La cetoacidosis diabética es una complicación aguda de la diabetes que se caracteriza por hiperglucemia, acidosis metabólica, deshidratación y presencia de cuerpos cetónicos. Este cuadro es desencadenado generalmente por infecciones o mal apego al tratamiento.
La deficiencia de insulina genera incapacidad para introducir glucosa a las células, lo cual dificulta la obtención de energía por parte de las mismas. Bajo estas circunstancias, comienzan a oxidarse ácidos grasos y se obtiene energía a partir de la acetilcoenzima A (acetil-CoA). La acumulación de ésta promueve y aumenta la producción de cuerpos cetónicos: acetoacetato, -hidroxibutirato y acetona. De estos tres, la acetona es volátil y es eliminada por la respiración, otorgando a los pacientes con cetoacidosis el aliento característico a manzana; el acetoacetato y el -hidroxibutirato son ácidos que pueden utilizarse para favorecer la producción de energía; sin embargo, la acumulación de estas moléculas genera una disminución del pH y, en consecuencia, acidosis (figura 6).
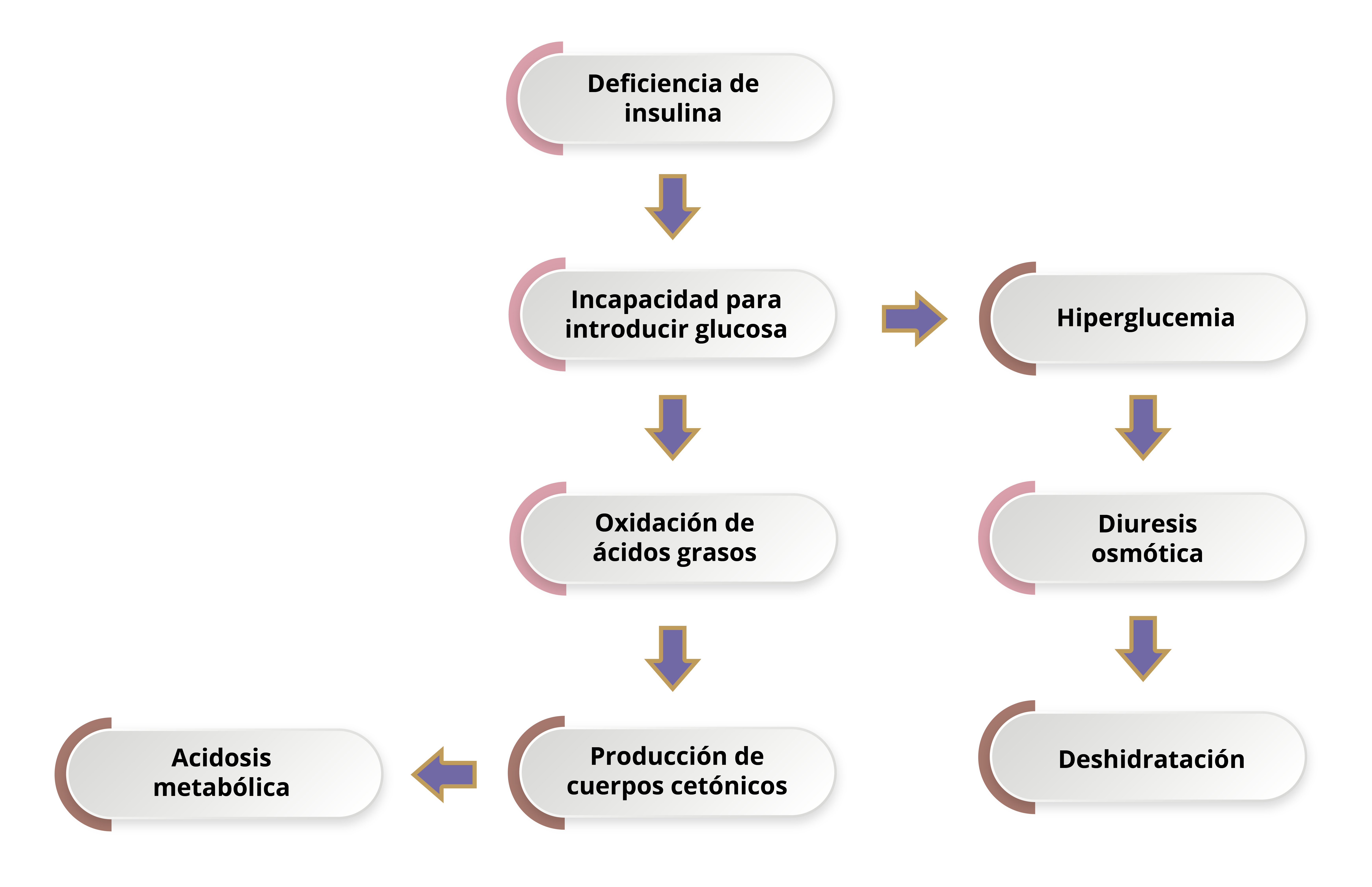
Figura 6. Esquematización de los mecanismos que generan cetoacidosis diabética. Los recuadros resaltados en rojo representan las características clínicas de este padecimiento.
Por otra parte, la glucosa, al no ser captada en tejidos periféricos, comienza a acumularse en el plasma, generando hiperglucemia. En individuos sanos, toda la glucosa filtrada se reabsorbe; sin embargo, cuando existen niveles de glucosa plasmática >180 mg/dl, el riñón se satura y es incapaz de reabsorber la glucosa por completo, lo que produce pérdida de ésta en la orina. La glucosa, al ser una molécula osmóticamente activa, ocasiona ósmosis, pérdida de agua y deshidratación.
El estado ácido-base se encuentra estrictamente regulado mediante tres mecanismos principales que compensan cambios en el pH a lo largo de tiempos distintos: amortiguadores químicos, regulación respiratoria y renal.
Los trastornos ácido-base se caracterizan por cambios en el pH plasmático, el cual, en condiciones normales, debe encontrarse entre 7.35 y 7.45. Valores menores de 7.35 manifiestan la presencia de acidemia, mayores de 7.45, alcalemia. Estos trastornos se evalúan mediante la gasometría arterial, tomando en consideración la PaO2, el pH plasmático, el nivel de pCO2 y, finalmente, el de HCO3. Dependiendo de los valores de cada uno, se obtiene un trastorno primario, el cual puede ser metabólico o respiratorio.
El entendimiento del estado ácido-base es de especial importancia para comprender la fisiología del organismo y las potenciales alteraciones que pueden presentarse. Múltiples desencadenantes frecuentes en la práctica clínica son capaces de generar trastornos en el estado ácido-base, como la cirugía, la presencia de trauma, la diabetes, el asma, etc., por lo cual es importante conocer los mecanismos subyacentes para poder identificarlos oportunamente y entender los principios terapéuticos de los mismos.
Ahora que revisaste generalidades sobre la regulación ácido-base, te presentamos una serie de reactivos cuyo objetivo es poner en práctica tu conocimiento sobre el tema.
Con los conocimientos obtenidos a lo largo de la UAPA, se te presentará un caso clínico en donde podrás reconocer un diagnóstico de los trastornos ácido-base.
Fuentes de información
Bibliografía
Brown, T. E., Bursten, B. E., Murphy, C. y Woodward, P. (2018). Chemistry. The central science (14.a ed.). Pearson.
Carrillo, R. (2008). Clínicas Mexicanas de Anestesiología. Clínica de líquidos y electrolitos (vol. 9). Alfil.
Hall, J. E. y Guyton, A. C. (2010). Guyton y Hall. Tratado de fisiología médica (12.a ed.). Elsevier.
Nelson, D. L. y Cox, M. M. (2013). Lehninger. Principles of biochemistry (6.a ed.). W. H. Freeman and Company.
Skorecki, K., Chertow, G. M., Marsden, P. A., Taal, M. W. y Yu, A. S. L. (2016). Brenner and Rector’s. The kidney (10.a ed.). Elsevier.
Voet, D. y Voet, J. G. (2010). Biochemistry (4.a ed.). John Wiley and Sons.
Documentos electrónicos
Kaufman, D. A. (s. f.). Interpretation of arterial blood gases (ABGs). American Thoracic Society. https://www.thoracic.org/professionals/clinical-resources/critical-care/clinical-education/abgs.php
Cómo citar
Ramírez, D., Perea, V. G. y Díaz, J. C. (2023). Regulación del Equilibrio Ácido-Base y Trastornos. Unidades de Apoyo para el Aprendizaje. CUAIEED/Facultad de Medicina-UNAM. [Vínculo]