En esta unidad de apoyo para el aprendizaje (UAPA), revisarás generalidades sobre ácidos y bases, la ionización del agua, su relación con la escala de pH, la constante de disociación y la ecuación de Henderson-Hasselbalch.
Este tema es importante porque el equilibrio ácido-base es esencial para el funcionamiento del cuerpo humano y para múltiples procesos celulares; además, diversos estados patológicos generan alteraciones en el pH. El tema te servirá en un futuro para conocer el equilibrio ácido-base de tus pacientes.
Gregortrefalt. (2017). Colores de azul de bromotimol a diferentes pH [fotografía]. Tomada de https://bit.ly/3EutjES
Según la teoría de Brønsted-Lowry, un ácido representa una molécula que dona protones (H+); una base, una molécula que los acepta. Esto puede visualizarse de la siguiente forma —ver ecuación 1— (Voet y Voet, 2016):

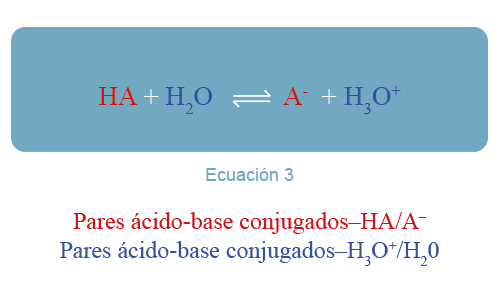
En el ejemplo, el ácido clorhídrico (HCl) transfiere un protón a la molécula de agua, actuando como un ácido. El agua, en cambio, acepta el protón, actuando como una base. Todas las reacciones ácido-base involucran movimiento de protones, por lo que la reacción 1 puede generalizarse de la siguiente manera, donde HA es un ácido que se disuelve en agua —ver ecuación 2—:

En la reacción hacia la derecha, la molécula HA cede un protón funcionando como ácido y permanece el anión A–. En la reacción hacia la izquierda, el anión acepta un protón, funcionando como base. A esto se le denomina pares ácido-base conjugados; es decir, cada ácido tiene una base conjugada que se forma al remover un protón de éste y viceversa —ver ecuación 3—.
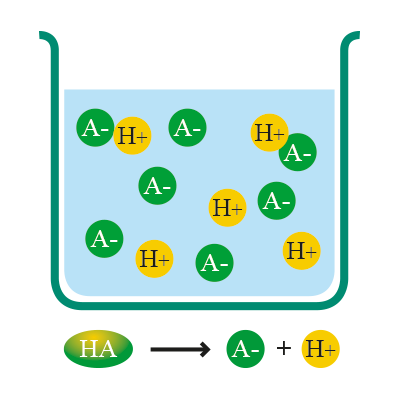
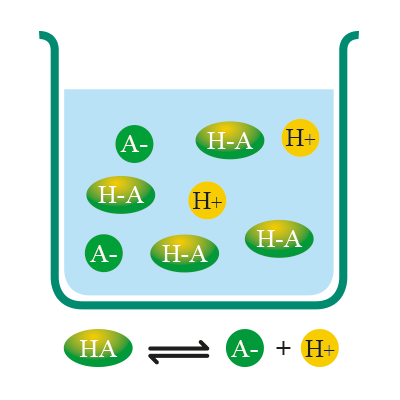
Algunos ácidos son más propensos a ceder protones que otros; por ello, existen ácidos fuertes y débiles:
Son aquellos que tienen mayor tendencia a disociarse y perder protones para generar una base conjugada.
Ácido fuerte
Son los que se disocian sólo de manera parcial en solución acuosa.
Ácido débil
Cabe destacar que mientras más fuerte sea el ácido, más débil es su base conjugada; de igual forma, mientras más débil sea el ácido, más fuerte es su base conjugada. Los mismos conceptos aplican para las bases, las cuales también pueden ser fuertes o débiles, según su tendencia de aceptar protones.
Ahora que hemos revisado los conceptos generales de ácidos y bases, es importante revisar la disociación de éstos.
Todas las reacciones químicas poseen una constante de equilibrio. Revisa la siguiente reacción —ver ecuación 4—:

La ecuación 4 representa una reacción reversible que puede proceder hacia la derecha o hacia la izquierda ( ); se encuentra en equilibrio cuando las reacciones en ambas direcciones se dan a la m isma velocidad. Por lo tanto, la concentración de los reactantes y de los productos se mantiene constante.
); se encuentra en equilibrio cuando las reacciones en ambas direcciones se dan a la m isma velocidad. Por lo tanto, la concentración de los reactantes y de los productos se mantiene constante.
La constante de equilibrio (Keq) se calcula según la concentración de reactantes y productos de la siguiente forma —ver ecuación 5—:


Toma nota…
En las reacciones ácido-base, la constante de equilibrio también se denomina de disociación, cuya importancia se verá más adelante; no obstante, primero es esencial que veas qué es la ionización del agua.
Debido a que las reacciones ácido-base en el cuerpo humano se llevan a cabo en soluciones acuosas, es importante tener en cuenta que el agua posee diversas propiedades especiales que requieren atención.
Primeramente, el agua puede actuar como ácido o base, ya que es una molécula anfótera; se comportará como ácido si interactúa con una sustancia más básica; como base, con una sustancia más ácida. Por otra parte, una molécula de agua es capaz de ceder un protón a otra de agua —ver ecuación 6—:

Esta reacción suele expresarse de manera simplificada como —ver ecuación 7—:

No es común la disociación del agua. A temperatura de 25 °C, sólo dos de cada 109 moléculas de agua se encuentran ionizadas en cualquier momento. Para determinar el grado de disociación del agua, se utiliza su constante de equilibrio. Basándose en dicha constante —ecuación 5—, se obtiene —ver ecuación 8—:

La concentración de agua (H2O) es constante y tiene un valor de 55.5 mol. Por otra parte, la constante de equilibrio se ha determinado experimentalmente y es de 1.8 x 10–16. Si se sustituyen y se agrupan los valores conocidos en la fórmula, se obtiene —ver ecuación 9—:

Al producto de “(55.5 mol) (1.8 x 10–16)”, se le denomina producto iónico del agua (Kw); por lo tanto —ver ecuación 10—:

Al resolver la aritmética, se obtiene el valor del producto iónico del agua —ver ecuación 11—:

Lo que Kw representa es que, en una solución acuosa, el producto de la concentración de protones H+ y aniones OH– siempre será igual a 1.0 x 10–14. Si se incrementa la concentración de H+, debe disminuir la de OH– para mantener Kw = 1.0 x 10–14 y viceversa. De esto, surgen conceptos significativos:
Una vez que tenemos el valor del producto iónico del agua, se puede obtener la concentración de protones en una solución acuosa neutra —ver ecuación 12—:

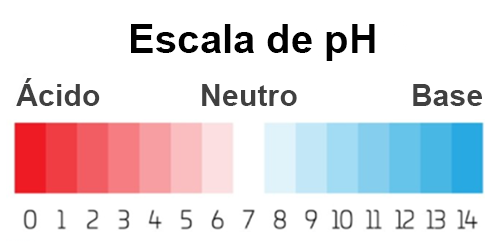
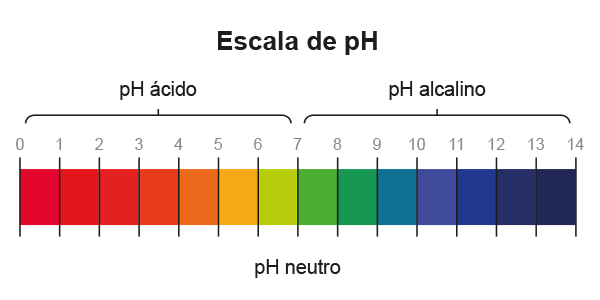
Debido a que estas concentraciones son muy pequeñas, se utiliza la escala de pH,la cual es una escala logarítmica para facilitar la expresión de los valores:

De esta forma, se obtiene el pH del agua pura. Por lo tanto, y basado en lo que se ha comentado anteriormente:
Escala de pH

Debes recordar que esta escala es logarítmica, no lineal, lo cual tiene implicaciones significativas, ya que cambios aparentemente pequeños pueden tener variaciones importantes en la concentración de protones. El cambio de una unidad de pH significa una diferencia de 10 veces el valor inicial; es decir, una solución con pH de 4.0 tiene 1000 veces más H+ que una solución neutra.
Anteriormente, se mencionó la constante de disociación como un equivalente de la de equilibrio en reacciones ácido-base. En la reacción —ver ecuación 15—…

… se puede obtener la constante de disociación (Ka), basándose en la de equilibrio —ecuación 5— y sustituyendo —ver ecuación 16—:

La constante de disociación señala el pH en el cual las concentraciones de ácido y base conjugados son iguales. Este valor permite conocer el tipo de ácido: uno con constantes grandes es fuerte; con bajas, es débil.
Para evitar el manejo de cifras pequeñas, se adaptó el concepto logarítmico del pH a la constante de disociación —ver ecuación 17—:

Con estos conceptos, es posible saber el pH de una solución si se conoce la concentración de ácidos, bases y la constante de disociación. La ecuación de Henderson-Hasselbalch nos permite calcular el pH, la pKa, así como la concentración de ácidos o bases, como se muestra a continuación:

Pasos para realizar la ecuación de Henderson-Hasselbalch
Como puedes ver, esta ecuación permite calcular el pH, la pKa, así como la concentración de ácido o base si se tienen los otros valores. Para ayudarte a comprender la aplicación práctica de esta ecuación, te invitamos a ver el siguiente ejemplo:
Ejemplo de aplicación de los pasos en un caso
Anteriormente, se mencionó que mientras más grande sea la constante de disociación, más fuerte será el ácido. Debe notarse que, si se usa la pKa, sucede lo contrario; mientras más pequeña sea la pKa, más fuerte será el ácido y viceversa. Lo mismo aplica con las bases. En la siguiente tabla, se pueden ver ejemplos de ácidos y su constante de disociación; el ácido sulfúrico y nítrico representan ácidos fuertes, mientras que el ácido acético y carbónico son débiles; nota la diferencia de pKa.
| Ácido | K | pKa |
| Ácido sulfúrico | 1 x 102 | -2.0 (pK1) |
| Ácido nítrico | 2.3 x 101 | -1.37 |
| Ácido acético | 1.74 x 10–5 | 4.76 |
| Ácido carbónico | 4.47 x 10–7 | 6.35 (pK1) |
(s. a.) (2023). Ejemplos de ácidos y su constante de disociación [tabla]. Elaborada con base en Voet, D. y Voet, J. G. (2016). Biochemistry.
Como se ha visto a lo largo del texto, los ácidos son moléculas que donan protones (H+), mientras que las bases los aceptan. El agua es una molécula anfótera cuyo producto iónico es la base de la escala de pH. Esta escala es logarítmica, donde un valor de 7 representa un pH neutro, uno menor de 7 un pH ácido y uno mayor de 7 un pH básico.
Escala de pH
La constante de disociación señala el pH en el cual las concentraciones de ácido y base conjugados son iguales. Si se conoce la constante y la concentración de ácido y base en una reacción, se puede obtener el pH mediante la ecuación de Henderson-Hasselbalch.
Como has visto, los ácidos y las bases juegan un papel de suma importancia para el cuerpo humano.
Identificar los principales conceptos y ecuaciones revisados en el texto te será de gran ayuda para comprender el papel que tienen los ácidos y las bases en la fisiología del cuerpo humano.
Como has visto a lo largo de esta UAPA, la escala de pH va desde el 0 —ácidos fuertes— hasta el 14 —bases fuertes—, donde el número 7 es el punto medio —neutro—. El pH sanguíneo se encuentra fuertemente regulado por el organismo; valores fuera de lo normal pueden causar trastornos en el equilibrio ácido-base.
Fuentes de información
Bibliografía
Brown, T. L., LeMay, H. E., Bursten, B. E., Murphy, C. J., Woodward, P. M. y Stoltzfus, M. E. (2018). Chemistry: the central science (14.a ed.). Pearson.
Hall, J. E. y Guyton, A. C. (2010). Guyton y Hall. Tratado de fisiología médica (12.a ed.). Elsevier.
Nelson, D. L. y Cox, M. M. (2013). Lehninger. Principles of biochemistry (6.a ed.). W. H. Freeman and Company.
Skorecki, K., Chertow, G. M., Marsden, P. A., Taal, M. W. y Yu, A. S. L. (2016). Brenner and Rector's the kidney (10.a ed.). Elsevier.
Voet, D. y Voet, J. G. (2016). Biochemistry (4.a ed.). John Wiley and Sons.
Cómo citar
Ramírez, D., Perea, V. G. y Díaz, J. C. (2023). Generalidades del Equilibrio Ácido-Base. Unidades de Apoyo para el Aprendizaje. CUAIEED/Facultad de Medicina-UNAM. (Vínculo)