Desde una simple taza de café hasta una compleja reacción de PCR, las soluciones están a nuestro alrededor. Es importante que consideres que todos los procesos celulares se llevan a cabo en un medio acuoso, el cual contiene múltiples sustancias (solutos). La presencia de estas sustancias altera de manera importante las propiedades de este medio acuoso. Es de vital importancia que los seres vivos (a todos sus niveles de organización), regulen estas propiedades. De hecho, alteraciones en las cantidades de sustancias disueltas en los múltiples compartimientos corporales tienen efectos adversos sobre la función del cuerpo; y pueden potencialmente poner en riesgo la vida.
Una de las maneras más comunes en las cuales se describen las soluciones en la relación de cuantas partes de soluto hay por el total de la solución. Esta proporción recibe el nombre de concentración y es usualmente expresada mediante unidades de masa sobre unidades de volumen.
En el siguiente esquema, puedes ver a grandes rasgos las características de las soluciones.
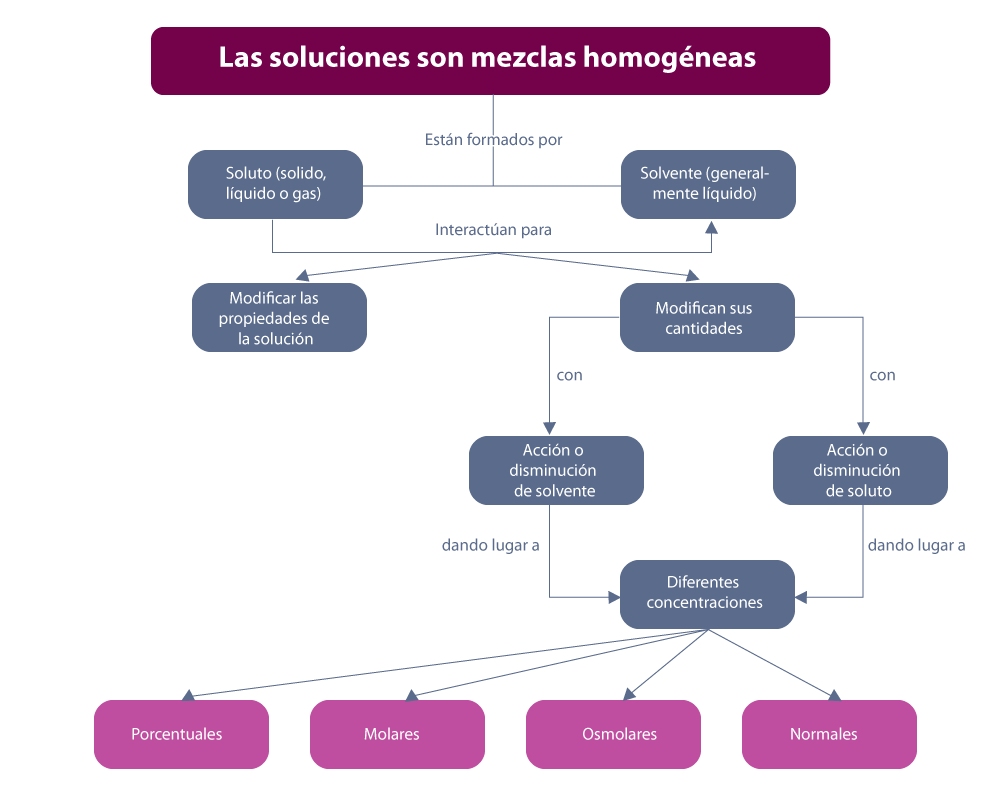
Elaboración propia, con base en Umbarila. (2012). Las soluciones [esquema]. Tomado de https://bit.ly/2Msv5Pe
Aplicar las principales fórmulas para el cálculo de concentración, con la finalidad de determinar la cantidad de soluto y el volumen de solvente dentro de una solución.
Una solución es una mezcla homogénea a nivel molecular o iónico de dos o más sustancias puras que no reaccionan entre sí, cuyos componentes se encuentran en proporciones variables. También se puede definir como una mezcla homogénea formada por un solvente y por uno o varios solutos. Un ejemplo común podría ser un sólido disuelto en un líquido, como la sal o el azúcar disueltos en agua.
Características generales de las soluciones:
En química, la concentración de una solución es la proporción o relación que hay entre la cantidad de soluto y la cantidad de disolución. Se trata de una característica cuantitativa. Algunas de estas formas cuantitativas de medir la concentración son:
Es importante mencionar que existen más formas para medir una concentración, pero en esta UAPA nos enfocaremos en las que se mencionaron anteriormente.
Es momento de revisar cada una de las soluciones existentes y sus respectivas fórmulas para el cálculo de concentración.
Las soluciones porcentuales son aquellas cuya medida es la cantidad de mililitros (%v/v) o gramos (%p/v) por cada 100 mL de solución (no de solvente).
Ejemplo: Una solución al 10% contendrá 10 gramos o 10 mL, aforados a 100 mL de solución. Para preparar una solución al 25%, entonces 25 gramos (%p/v) o 25 mL (%v/v) del soluto se aforan hasta 100 mL.
Por lo tanto:
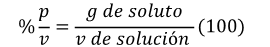
Fórmula 1
A partir de la fórmula1 se puede obtener los gramos de soluto o el volumen de la solución, si es que se conocen los datos adecuados. Por ejemplo, si conocemos la concentración porcentual (%p/v) de una solución podemos conocer cuál es la cantidad de soluto que esta tiene.
Ejemplo: si tenemos una solución al 45% (% p/v) de cloruro de sodio (NaCl) y sabemos cuál es el volumen de la solución (35 mL), podremos saber cuánto cloruro de sodio en gramos hay en dicha solución.
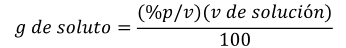
Por lo tanto:
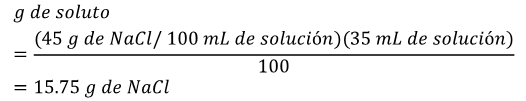
Son aquellas en las que la masa del soluto está expresada en moles por litro de solución.
Ejemplo: una mol de cloruro de sodio (NaCl) son 58.5 g. Por lo tanto, una solución 1M de NaCl contendrá 58.5 g de NaCl por litro de solución.
La fórmula para el cálculo de la molaridad es:
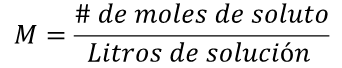
Por lo tanto:
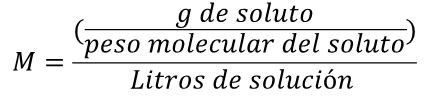
Fórmula 2
Con la fórmula 2 se puede calcular no solo la molaridad de una solución, sino que también podemos calcular la cantidad de masa necesaria para preparar una solución con características específicas.
Ejemplo: si queremos preparar 300 mL de una disolución de ácido clorhídrico (HCl) 2.34 M, ¿Cuántos g de HCl se necesitan para preparar esa solución?
La masa molar del HCl es de 36.5 g/mol, despejando la fórmula 2 obtenemos:

Por lo tanto:
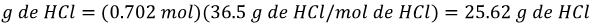
Este ejemplo lo podemos extender más, ya que el HCl es un líquido. Por lo tanto, para preparar una solución como la que se planteó se requiere medir el volumen de ácido en lugar de pesarlo. Para poder calcular los mL de HCl que se necesitan para preparar la solución se necesita conocer la densidad del HCl la cual es de 1.12 g/mL
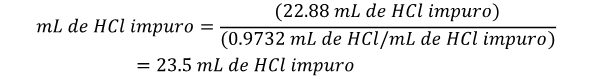
Son aquellas en las que en 1 litro de agua hay disuelto un equivalente del soluto. Es decir, el peso molecular de la sustancia dividido por el número de electrones que intercambia en la reacción.

Fórmula 3
En el caso de la normalidad en lugar de utilizar los moles de un soluto, se utilizan los equivalentes del mismo que de forma general se refieren a las cargas netas que una molécula en solución forma al disociarse.
Ejemplo:
H2SO4+ H2O -----> 2H+ + SO42- + H2O
El ácido sulfúrico (H2SO4) en solución acuosa se disocia en 2H+ y SO42- lo que nos indica que tiene dos equivalentes ya que la carga neta que se genera es de 2. Si contamos con 88 g de H2SO4 y los disolvemos en 0.750 L de agua, la normalidad de la solución la calculamos utilizando la fórmula 3, de la siguiente manera:
Primero consideramos que el peso molecular del H2SO4 es 98.0 g/mol

Es la concentración de soluto expresada en número de osmoles por litro de solución; es decir, el número de partículas totales en solución. Por ejemplo, si una partícula se disocia en dos al estar disuelta en agua, se consideran dos partículas en solución. Además, la concentración osmolar de una solución que contiene una mezcla de electrolitos y moléculas neutras, la osmolaridad de la solución es igual a la suma de las concentraciones osmolares individuales de todos sus componentes. Es decir, los osmoles de cada componente individual se suman para obtener la osmolaridad total de la solución.
Ejemplos:
Calcular la osmolaridad de una solución de NaCl 0.25 M
El NaCl se ioniza completamente formando dos iones
Por lo tanto: Osmolaridad = 0.25 x 2 = 0.5 osmolar.
Nota: La actividad osmótica de las sustancias que se ionizan es mayor que la de las sustancias que no se ionizan. Además, la actividad osmótica únicamente depende del número de partículas en solución, no del tamaño de éstas.
¿Cuál es la osmolaridad de una solución de sulfato de potasio (K2SO4) 0?5 Molar?
El K2SO4 se ioniza produciendo 3 iones en solución:
K2SO4 -----> 2 K+ + SO4-2
Por lo tanto: Osmolaridad = 0.5 x 3 = 1.5 osmolar
En química, la dilución es la reducción de la concentración de una sustancia química en una solución. La dilución consiste en disminuir la cantidad de soluto por unidad de volumen de solución. Dicho de otra manera, se trata de reducir la concentración de una solución, se logra adicionando más solvente a la misma cantidad de solución, esto en términos de las ecuaciones anteriormente mencionadas podemos decir que:
Donde la concentración puede estar dada en cualquiera de los términos antes mencionados (molaridad, normalidad, osmolaridad y porcentual). Bajo esta lógica, que la cantidad de soluto inicial será igual a la cantidad de soluto final (en un volumen mayor), se puede deducir que:
Si consideramos que:
Entonces:
Fórmula 4
Con esta fórmula podemos calcular el volumen que se necesita para preparar una dilución si conocemos la concentración de la solución de la cual estamos partiendo o podemos calcular la concentración de una solución si sabemos el volumen que se usó para preparar una dilución de una concentración conocida. Esta fórmula se utiliza comúnmente para preparar soluciones diluidas a partir de soluciones más concentradas.
Ejemplo: Se quiere calcular cuantos mL de una solución 6.3 M de hidróxido de magnesio (Mg(OH)2), se necesitan diluir para preparar 386 mL de una solución 4 M. Usando la fórmula 2 de disoluciones:
Despejando el volumen inicial
Se tienen 435 mL de una disolución de óxido de calcio (CaO) en una concentración de 0.63 M y se sabe que esta se preparó a partir de 25 mL de otra solución, ¿cuál fue la concentración de la solución original?
Despejando la concentración inicial
La ósmosis es una propiedad intrínseca de las soluciones. Es necesario mantener un equilibrio de los solutos presentes en el medio intra y extracelular.
La ósmosis la podemos definir como la difusión pasiva del agua a través de una membrana semipermeable, desde la solución más diluida hacia una más concentrada. A partir de eso, podemos decir que la presión osmótica es aquella presión necesaria para detener el flujo de agua a través de la membrana semipermeable. Al considerar como semipermeable a la membrana plasmática, las células de los organismos pluricelulares deben permanecer en equilibrio osmótico con los líquidos tisulares que los bañan (plasma y líquido intersticial). Sin embargo, para comprender más este tema, primero debemos definir conceptos base como anión, catión y electrólito.
En el siguiente esquema te mostramos el equilibrio osmótico entre el plasma y el líquido intersticial.
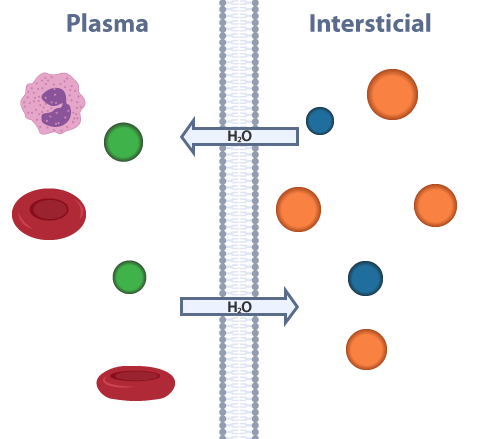
Equilibrio osmótico
Los iones son átomos o moléculas que tienen una carga (positiva o negativa), ya que tienen números desiguales de protones y electrones. Si los átomos pierden electrones, se convierten en iones positivos (cationes). Por otro lado, si los átomos ganan electrones se convierten en iones negativos (aniones). A partir de la definición de un ion podemos decir que un electrolito se refiere a la capacidad de conducir corriente eléctrica gracias a la acción de iones, una característica peculiar de estas especies químicas. Sin embargo, en la medicina el término electrolito hace referencia a los iones presentes en la sangre y otros líquidos corporales.
En el ser humano los solutos están representados por iones (Na+, K+, Cl-, Ca2+, Mg2+) y moléculas orgánicas de mayor peso molecular (glucosa, urea, proteínas) los cuales se distribuyen en diferentes proporciones entre los dos compartimientos principales, intracelular y extracelular. El cuerpo se mantiene en un equilibrio hidroelectrolítico, lo que significa que cada uno de los compartimentos tiene las mismas proporciones de agua y solutos.
La osmolaridad del plasma sanguíneo humano es de 280-320 mOsm/L (1 Osmol = 1000 mOsmoles). En clínica, es común emplear la siguiente fórmula que nos da una aproximación al valor de la osmolaridad del plasma de una persona:
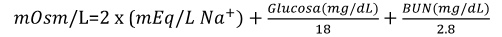
Fórmula 5
Esta fórmula sirve para calcular la osmolaridad del plasma.
Ejemplo: Para determinar la osmolaridad del plasma de un paciente con síndrome metabólico: glucosa de 250 mg/dL, BUN de 80mg/dL y sodio de 145 mEq/L:

La capacidad de una solución de mover el agua hacia adentro o hacia afuera de una célula por ósmosis se conoce como su tonicidad. La tonicidad de una solución está relacionada con su osmolaridad, que es la concentración total de todos los solutos en la solución. En una situación fisiológica se define en términos de la concentración de las soluciones a ambos lados de una membrana: si la osmolaridad es igual de un lado y otro de la membrana se habla de soluciones isoosmóticas; si la solución extracelular tiene mayor concentración que la del interior de la célula es hiperosmótica. Finalmente, cuando la solución tiene menor concentración que la del interior de la célula se denomina hiposmótica. A continuación, te presentamos un esquema de una solución isoosmótica (izquierda), de una solución hiperosmótica (centro) y de una solución hipoosmótica (derecha). Las flechas representan el flujo de agua a través de la membrana celular.
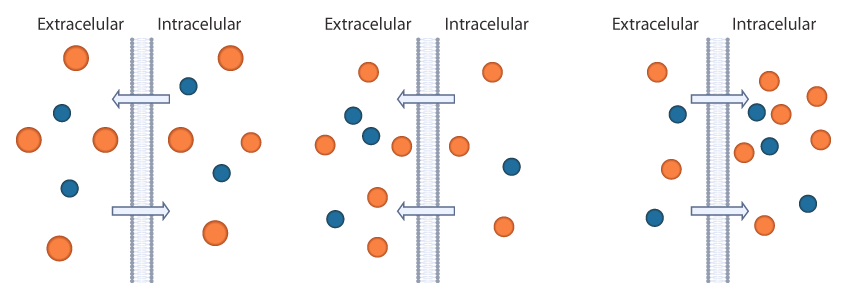
Esquema de una solución isoosmótica, hiperosmótica e hiposmótica
Por otro lado, si se toma en cuenta el efecto sobre el volumen celular, cuando una solución no cambia el volumen de las células, se dice que es isotónica; si produce un aumento del volumen celular o inclusive la ruptura de la célula, la solución es hipotónica; mientras que, si induce una contracción del volumen de la célula por la salida de agua, es una solución hipertónica. Te presentamos un esquema donde se muestra el flujo de agua en un glóbulo rojo estando en una solución hipertónica (izquierda), en una solución isotónica (centro) y en una solución hipotónica (derecha).
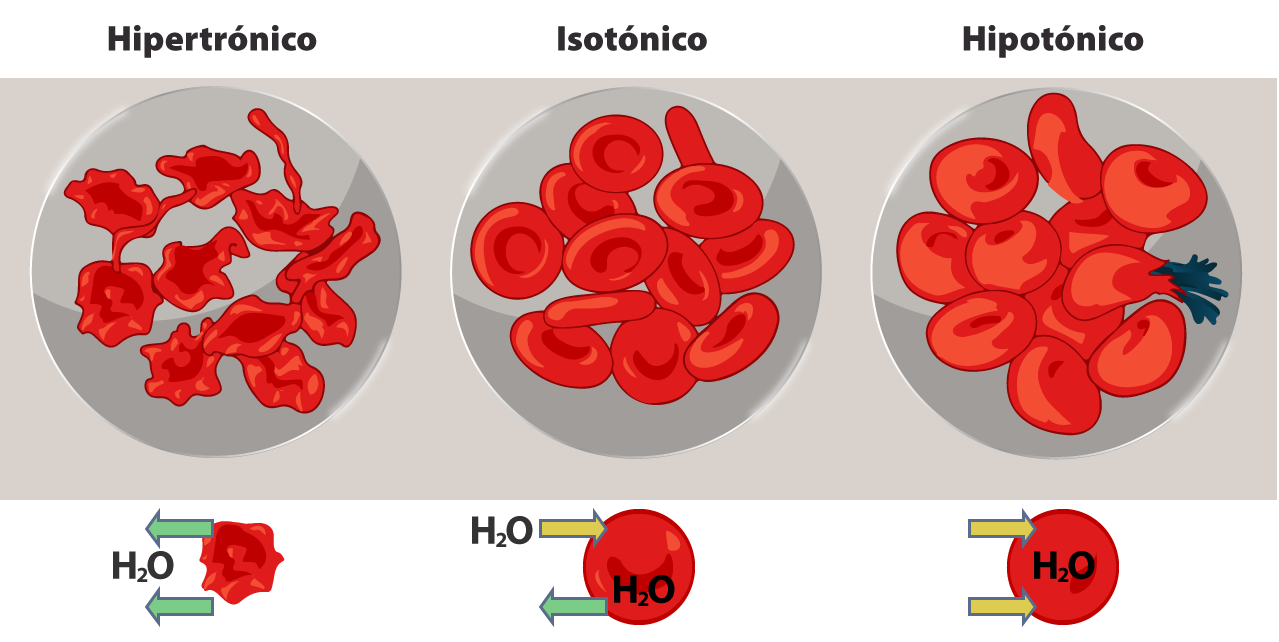
LadyofHats. (2007). Osmotic pressure on blood cells diagram [illustrations]. Tomada de: https://en.wikipedia.org/wiki/Osmosis#/media/File:Osmotic_pressure_on_blood_cells_diagram.svg
Un buen ejemplo es el de los glóbulos rojos (eritrocitos) suspendidos en soluciones de distinta concentración: cuando se colocan en agua o en soluciones salinas con menos de 280 miliosmoles por litro, los glóbulos rojos se hinchan debido al flujo de agua hacia su interior para igualar la concentración de solutos dentro y fuera del glóbulo. Como consecuencia de este flujo de agua, la membrana del eritrocito no resiste la presión y se puede producir la hemólisis (ruptura de los glóbulos rojos). Cuando estas células se colocan en soluciones con más de 320 miliosmoles por litro, los glóbulos pierden agua y se encogen alterando su morfología. Al poner a los eritrocitos en una solución con 280-320 miliosmoles por litro, entra y sale la misma cantidad de agua, manteniendo el equilibrio.
La isotonicidad entre todas las células y los compartimientos líquidos debe mantenerse constante; cualquier alteración implica su corrección inmediata para regresar al equilibrio. Por ejemplo, si se bebe mucha agua y la sangre se diluye, la osmolaridad de esta baja y pasa más agua de la sangre a los tejidos; el organismo tiende a restablecer el equilibrio eliminando agua por vía renal.
Las soluciones son la mezcla homogénea de un soluto en un solvente. Una forma de caracterizar a las soluciones es la concentración; es decir, la relación de cantidad de soluto por volumen de solvente. En el contexto de la célula (y del cuerpo humano) conocer la concentración de los diferentes compartimentos celulares es importante para entender el flujo de agua a través de ellos.

Recuerda que…
El uso de fórmulas para cálculos de concentraciones es esencial para el médico, ya que constantemente se administran fármacos a dosis muy precisas; igualmente el conocer las soluciones y sus unidades es necesario para interpretar resultados de laboratorio. Finalmente, es común administrar soluciones con composiciones específicas para mantener estables a los pacientes ante una enfermedad o accidente. Por ejemplo: los sueros isotónicos (Dextrosa al 5.0% o NaCl al 0.9%), solución Ringer, Vida Suero Oral, entre otras.
Para que puedas aplicar las diferentes fórmulas para los cálculos de concentraciones, es importante que primero identifiques ciertos conceptos que te ayudarán a comprender mejor el tema, por ejemplo, qué es una solución, cuáles son sus características, qué es una concentración, entre otros.
Después de hacer un recorrido conceptual, es fundamental que antes de pasar a la aplicación de las fórmulas sepas identificar para qué sirve cada una.
Como lo pudiste observar en secciones previas, la concentración es una proporción; es decir, es una relación de cuantas partes de soluto hay por cada parte de la solución. Por lo tanto, para su determinación puedes hacer uso de alguna de las fórmulas que se te presentaron en cada una de las secciones. Cualquiera de estas es relativamente simple de usar; sin embargo, en ocasiones el mayor reto consiste en identificar que formula se requiere aplicar o el despeje correcto. En esta sección podrás practicar lo que aprendiste mediante varios ejercicios.
Bibliografía
Preston, R. (2011). Acid-base, fluids and electrolytes: made ridiculously simple. Miami: MedMaster.
Feld, L. y Kaskel, F. (2009). Fluid and electrolytes in Pediatrics: A comprehensive handbook. New York: Springer Science & Business.
Segel, I. (1975). Biochemical calculations. New York: John Wiley & Sons.
Sitios electrónicos
Umbarila, X. (2012). Fundamentos teóricos para el diseño y desarrollo de unidades didácticas relacionadas con las soluciones químicas. Revista de Investigación, 36(76), 133-157. Recuperado el 25 de Febrero de 2021 de https://www.redalyc.org/articulo.oa?id=3761/376140391007
Cómo citar
Escalona, R., J., Mendoza, X., A., Novo, L., R. (2021). Soluciones y cálculos de concentración. Unidades de Apoyo para el Aprendizaje. CUAIEED/Facultad de Medicina-UNAM. (Vínculo)