La vida de todo ser humano comienza con la unión de dos gametos, uno masculino (espermatozoide) y uno femenino (óvulo). Para que la fecundación se lleve a cabo, es necesario que estos gametos pasen por una serie de cambios bioquímicos, moleculares y morfológicos que los preparan para este proceso. A esta serie de preparativos se le llama gametogénesis; en el caso de los hombres, este proceso se divide en dos:
Ambos procesos son esenciales para la reproducción, y, a continuación, se revisarán en la siguiente figura los aspectos generales de ambos.
Representación de los principales acontecimientos de la gametogénesis masculina en humanos
Distinguir las dos etapas que conforman la gametogénesis masculina: la espermatogénesis y la espermiogénesis, con la finalidad de identificar la regulación de dichos procesos.
Las CGP’s son las células precursoras de los gametos en ambos sexos; en los humanos, se pueden identificar desde los 24 días después de la fecundación.
Estas células surgen a partir del epiblasto en la etapa de disco bilaminar, y, durante el desarrollo embrionario, salen del embrión para mantenerse en el saco vitelino. El destino final de las CGP’s son las crestas genitales, cuya formación ocurre cuando se engrosa la región caudal del mesonefros.
En el caso del sexo masculino, el producto del gen Sry (ubicado en el cromosoma Y) es el encargado de iniciar una cascada molecular que promueve la diferenciación de la gónada hacia un testículo. A finales de la quinta semana de gestación, las CGP’s llegan a la gónada en desarrollo. En los varones, una vez dentro del microambiente de la gónada masculina, las CGP’s se transforman en espermatogonias. Mediante señales provenientes de las células somáticas de la gónada, se mantienen en la fase G0 del ciclo celular hasta después del nacimiento.

Los teratomas, del griego tera (monstruo), son tumores que contienen tejidos que provienen de las tres capas embrionarias. Es decir, derivados del ectodermo, mesodermo y endodermo, por ejemplo: neuronas, músculo, sangre, incluso cabello y dientes.
Las CGP’s que fallan en su migración pueden generar este tipo de tumores dentro y fuera del testículo. Si consideramos que los gametos son capaces de formar un individuo completo, no es de sorprender que errores en la migración y desarrollo de las CGP’s formen tumores con todos los tipos celulares posibles. A esta capacidad de las CGP’s se le denomina totipotencialidad.
Los testículos son órganos bilaterales que se encuentran contenidos dentro de la bolsa escrotal. Están cubiertos por una capa fibrosa llamada túnica albugínea, y dentro de cada uno se encuentran gran cantidad de tubos contorneados denominados túbulos seminíferos. Éstos son la unidad funcional del testículo, y dentro de ellos se lleva a cabo la gametogénesis.
Los espermatozoides ya formados pasan a través de los túbulos seminíferos hacia los conductos eferentes; de ahí, se dirigen hacia el epidídimo, donde realizan su maduración. Una vez que han madurado, se desplazan hacia los conductos deferentes para, finalmente, ser expulsados por la uretra.
En la siguiente figura se puede ver las principales estructuras involucradas en la gametogénesis.
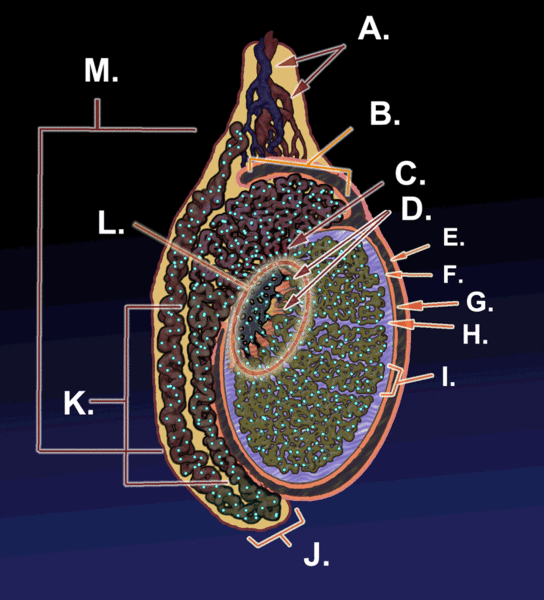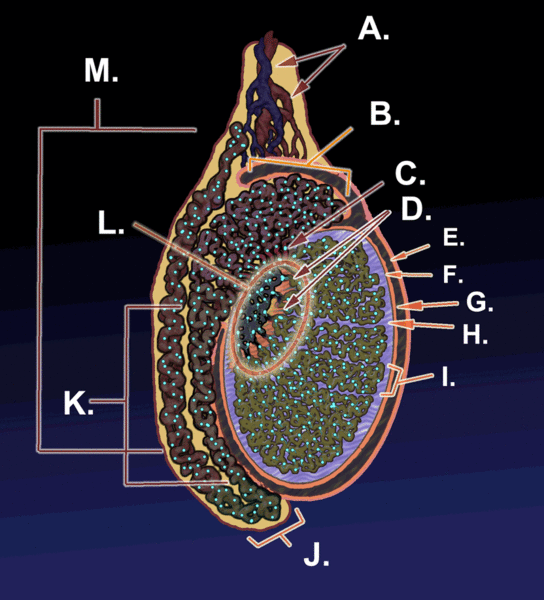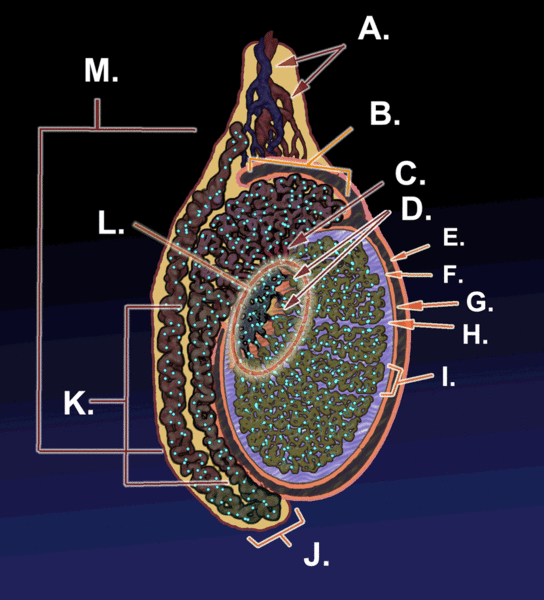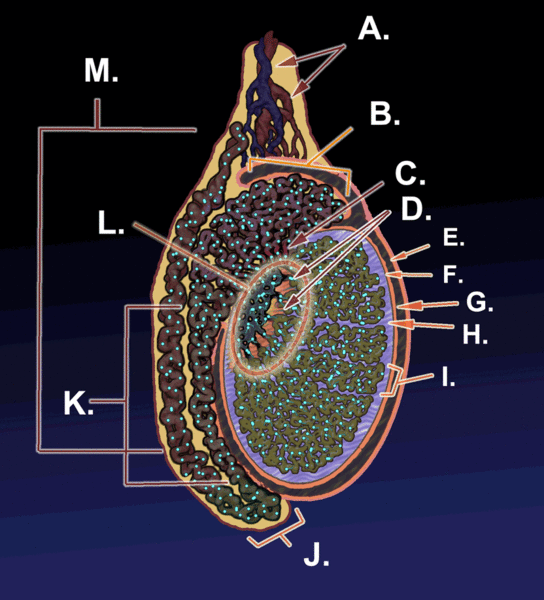
A Vasos sanguíneos
B Cabeza del epidídimo
C Conductos eferentes
D Túbulos seminíferos
E Lámina parietal de la túnica vaginalis
F Lámina visceral de la túnica vaginalis
G Cavidad de la túnica vaginalis
H Túnica albugínea
I Testículo
J Cauda del epidídimo
K Cuerpo del epidídimo
L Mediastino
M Conductos deferentes
KDS444. (2012). Figura 2. Esquema de un corte sagital de un testículo humano [gif]. Tomado de https://bit.ly/3eL5lJJ
Durante el desarrollo gonadal, las CGP’s llegan a la cresta genital y, junto con las células somáticas, forman los cordones sexuales. En la pubertad, estos cordones se convierten en túbulos seminíferos, y las espermatogonias quedan acomodadas en la membrana basal, es decir, en la periferia de los túbulos.
Estas células tienen un complemento cromosómico 2n 2c, por lo que son diploides. Corresponden a las células progenitoras que mantienen una reserva de células germinales a lo largo de toda la vida del hombre. Las espermatogonias constituyen una población heterogénea de células que incluye a las espermatogonias tipo A y tipo B (figura 3).
Para mantener una reserva de gametos a lo largo de toda la vida reproductiva de un hombre, es necesario mantener una reserva de gametos en constante regeneración. Esta reserva corresponde a las espermatogonias tipo A, las cuales realizan divisiones mitóticas. Durante las divisiones mitóticas, las espermatogonias tipo A pueden realizar una división asimétrica, es decir, generan una espermatogonia A y una célula que se compromete a iniciar meiosis, una espermatogonia tipo B.
La transición de espermatogonias de tipo A a tipo B está finamente controlada de manera tal que se evita la depleción de la reserva de gametos, así como que se generen tumores de células germinales.
Entre los factores involucrados en controlar este proceso, destacan la señalización por ácido retinoico, GDNF y por el par Kit/Kitl, provenientes de las células somáticas de la gónada.
Figura 3. Esquema que representa las dos subpoblaciones de espermatogonias
A diferencia de lo que ocurre en las mujeres, las espermatogonias inician meiosis hasta la pubertad. La entrada a meiosis está regulada por el aumento en los niveles locales de ácido retinoico. Por un lado, la enzima ALDH1A1 lo sintetiza y favorece que las espermatogonias entren a meiosis; por el otro, la degradación del ácido retinoico mediante la acción de la enzima CYP26B1 impide la entrada a meiosis.
El balance entre la síntesis y degradación del AR controla la entrada de las espermatogonias a meiosis. Hacia la luz del túbulo, justo por encima de las espermatogonias, se encuentra una capa formada por proyecciones de células somáticas de los túbulos seminíferos, las células de Sertoli (CS). Esta capa separa a las espermatogonias de las células que han entrado en meiosis.
Las CS son unas células alargadas, perpendiculares a la lámina basal del túbulo seminífero y, como se mencionó, forman proyecciones que emiten hacia la luz del túbulo que separan a las células que comienzan meiosis. Esta estructura se denomina barrera hematotesticular (BHT).
La BHT se encarga de evitar el contacto directo de células del sistema inmune con células meióticas, cuyas características genéticas y moleculares son distintas a las del individuo y, por lo tanto, evita la destrucción de éstas.
El siguiente caso clínico ejemplifica la importancia de la integridad del túbulo seminífero para la reproducción.

Paciente masculino de 36 años acude a consulta médica por un problema de infertilidad y reporta que, tras 12 meses de relaciones sexuales frecuentes sin protección, su pareja no ha quedado embarazada.
El paciente relata que su pareja tiene un hijo de un matrimonio previo, por lo que sospecha que él es el responsable de la incapacidad de concebir.
Al interrogatorio, relata que años atrás tuvo un accidente de motocicleta donde tuvo un impacto del escroto contra el tanque de gasolina. El médico concluye que el trauma recibido en este accidente ocasionó una ruptura de la barrera hematotesticular. Esta ruptura permitió que células del sistema inmunológico entraran al túbulo seminífero y “atacaran” a los precursores de los gametos, ocasionando infertilidad.
Como se mencionó previamente, al iniciar meiosis las células derivadas de las espermatogonias tipo b se mueven hacia la luz del túbulo seminífero, y ahora se les denomina espermatocitos primarios (EP).
Los EP atraviesan la barrera hematotesticular, y, de esta manera, se mantienen inmunológicamente aisladas para proseguir con la meiosis. Los EP, al estar realizando meiosis I, tienen un complemento cromosómico 2n 4c; además, sintetizan todas las proteínas que se requerirán más adelante para formar espermatozoides maduros. Entre los mecanismos moleculares involucrados en la progresión meiótica de los EP, se encuentra el producto del gen TEX11, el cual se encarga de regular la sinapsis de cromosomas homólogos durante la recombinación.
Asimismo, los EP son capaces de atravesar la BHT mediante el desensamble temporal de las uniones estrechas formadas por las CS, y de este modo se evita el paso de células y sustancias no deseadas.
Al final de la meiosis I, a los espermatocitos ahora se les denomina espermatocitos secundarios (ES), los cuales tienen una carga cromosómica 1n 2c; además, se mueven un nivel más hacia la luz del túbulo seminífero e inician la meiosis II. Finalmente, al terminar meiosis II se convierten en espermátides, las cuales son haploides (1n 1c); este proceso se resume en la tabla 1 y en la figura 4 de la estructura del túbulo seminífero.
Una característica que presentan las divisiones meióticas durante la espermatogénesis es que las células no experimentan una citocinesis completa. Las células resultantes de cada división celular se mantienen unidas por puentes intercelulares, formando un sincicio. De esta manera, la progresión a través de la meiosis se lleva a cabo de manera sincronizada.
Tipo celular |
Acontecimientos meióticos |
Composición cromosómica |
Espermatogonia |
Replicación del ADN (mitosis) |
2n 4c |
Espermatocito primario |
Primera división meiótica en curso |
2n 4c |
Espermatocito secundario (2) |
Segunda división meiótica en curso |
1n 2c |
Espermátides (4) |
Gametos haploides inmaduros |
1n 1c |
Espermatozoides (4) |
Gametos haploides maduros |
1n 1c |
Tabla 1. Resumen de los principales acontecimientos de la gametogénesis masculina en humanos
El control de la reproducción tanto en hombres como mujeres se regula por una asociación de glándulas denominada eje hipotálamo-hipófisis-gónada.
El hipotálamo secreta la hormona liberadora de gonadotropinas (GnRH, por sus siglas en inglés); por lo que, como su nombre lo indica, su función es estimular la secreción de gonadotropinas. La GnRH actúa sobre los gonadotropos ubicados en la adenohipófisis; dicho estímulo hace que secreten la hormona estimulante del folículo y la hormona luteinizante (FSH y LH, por sus siglas en inglés respectivamente). Ambas hormonas tienen sus respectivos blancos en el testículo: la FSH estimula a las células Sertoli (CS). Además, las células de Leydig (CL) se encuentran fuera de los cordones testiculares (en el intersticio), y tras ser estimuladas por LH, secretan testosterona que sintetizan a partir de colesterol. Una parte de esta hormona sale a la circulación y ejerce sus efectos periféricos, y una parte se mantiene en el testículo y promueve la espermatogénesis.
Por otro lado, las CS, en respuesta a FSH, producen la proteína fijadora de andrógenos (ABP, por sus siglas en inglés), la cual mantiene a la testosterona dentro del testículo a una concentración mayor que en el resto del cuerpo. Además, las CS producen inhibina, y tanto la testosterona como la inhibina salen a la circulación e inhiben la actividad secretora de la adenohipófisis y del hipotálamo. Este tipo de control de la actividad hormonal se le denomina retroalimentación negativa.
En la Figura 5 se representa el control hormonal de la reproducción, así como el sistema de retroalimentación negativo. Las flechas indican una acción estimulante, mientras que las líneas perpendiculares indican inhibición.
Escalona. (2020). Figura 5. Control hormonal de la gametogénesis masculina [esquema].
A pesar de tener la cantidad correcta de cromosomas, las espermátides no son capaces de fecundar un ovocito. Estas células deben adquirir las características morfológicas y funcionales de un espermatozoide, y a este proceso se le denomina espermiogénesis. Estas adaptaciones son necesarias para permitir su tránsito a través del tracto reproductor femenino, así como para poder realizar la fecundación. A continuación, se enlistan los organelos con los cambios más importantes que ocurren durante este proceso:
En la etapa de espermátide, el ADN está empaquetado mediante su asociación con histonas para formar cromatina. Para compactar aún más su núcleo, se sustituyen las histonas por protaminas.
Se desplaza sobre el núcleo hacia la parte apical del espermatozoide, y almacena las enzimas necesarias para el proceso de fecundación, como acrosina y la hialuronidasa. A partir de este punto, se le denomina acrosoma.
Se alargan y se desplazan a la base de la cola para organizar el flagelo.
Se ubican en la pieza media, donde generan la energía necesaria (ATP) para las contracciones del flagelo.
Reduce su volumen excretando parte de él en forma de vesículas llamadas cuerpos residuales, las cuales son absorbidas por las CS.
A pesar de estos cambios morfológicos, los espermatozoides son inmóviles e incapaces de fecundar al ovocito. Una vez que han terminado su maduración morfológica, son transportados al epidídimo; además de adquirir la capacidad de contraer el flagelo, los espermatozoides sufren una maduración bioquímica en la que se modifican las características de su membrana.
En la siguiente figura se representa la morfología de un espermatozoide normal tras el proceso de espermiogénesis.
Escalona. (2019). Figura 6. Morfología de un espermatozoide maduro [esquema].
Todo el proceso de espermatogénesis y espermiogénesis en humanos toma alrededor de 64 días, cada día se producen aproximadamente 100 millones de espermatozoides. Una característica de la gametogénesis masculina es que se producen múltiples espermatozoides con anomalías morfológicas y funcionales.
A pesar de tener un cierto número de espermatozoides con anomalías morfológicas y funcionales, un hombre puede ser fértil; sin embargo, múltiples factores ambientales y de estilo de vida pueden alterar de manera significativa la proporción de espermatozoides no viables, lo que puede llevar a casos de infertilidad.

Si deseas conocer más acerca de anomalías morfológicas y funcionales, te sugerimos revises el siguiente enlace de la Organización Mundial de la Salud (OMS).
Finalmente, si bien el espermatozoide es la célula responsable de fecundar al ovocito, requiere de múltiples moléculas y secreciones que permitan tanto la fecundación como su trayecto a través del sistema reproductor femenino. El conjunto de los espermatozoides y estas moléculas forman el semen.
Durante su tránsito en el tracto reproductor masculino, los espermatozoides van acumulando secreciones provenientes de diversas glándulas, este líquido recibe el nombre de semen. Los componentes el fluido seminal desempeñan un papel importante en la supervivencia de los espermatozoides, así como en la fecundación.
A continuación, se detallan los principales componentes del semen y la función que desempeñan:
| Glándula de origen (% del semen) | Componente | Función |
Testículo-epidídimo |
Espermatozoides |
Son los gametos maduros y se liberan aproximadamente 80 millones por ml de semen. |
Vesícula seminal |
Fructosa |
Este carbohidrato es una de las principales fuentes de energía para el movimiento del flagelo. |
Prostaglandinas |
Tienen un efecto inmunosupresor; además, están implicadas en el transporte de los espermatozoides en el tracto reproductor mediante las contracciones del músculo liso. |
|
Bicarbonato |
Actúa como amortiguador ante el pH ácido de la vagina. |
|
Próstata |
Citrato |
Este anión actúa como quelante de cationes divalentes. |
Zinc |
Es cofactor en múltiples proteínas del espermatozoide; además, participa en la capacitación y la fecundación. |
|
Glándulas bulbo uretrales |
Moco |
Interviene en la motilidad de los espermatozoides a través de la vagina y el cérvix. |
Elaboración propia, con base en la Organización Mundial de la Salud. (2010). Moléculas que componen en semen [tabla]. Tomada de https://bit.ly/2NuwUM8
Ahora ya conoces los aspectos generales de la producción de espermatozoides, así como su regulación. Esto te será de utilidad en contextos clínicos, como en casos de infertilidad y el empleo de anticonceptivos. Estas son las ideas básicas que debes de recordar:
Por último, te invitamos a revisar el siguiente video en el que se resume todo lo anteriormente visto.
Como pudiste observar en la UAPA, la espermatogénesis es un proceso muy importante para la reproducción humana, por ello es necesario que reconozcas los elementos que la componen.
Al revisar la importancia biológica de la gametogénesis y el proceso de diferenciación, se pudo identificar los cambios morfológicos que sufre una espermátide en los túbulos seminíferos para convertirse en un espermatozoide.
Bibliografía
Boron, W. y Boulpaep, E. (2016). Medical physiology E-book. Philadelphia: Elsevier.
Carlson, B. (2014). Embriología humana y biología del desarrollo. México: Elsevier.
Gilbert, S. (2000). Developmental Biology. Estados Unidos: Sunderland.
Lira, F., Bach, P., Najari, B., Li, P. y Goldstein, M. (2016). Spermatogenesis in humans and its affecting factors. Semin Cell Dev Biol, 59, 10‐26
Owen, D. y Katz, D. (2005). A review of the physical and chemical properties of human semen and the formulation of a semen simulant. Journal of Andrology, 26(4), 459-69.
Sitios electrónicos
World Health Organization. (2010). WHO laboratory manual for the examination and processing of human semen. World Health Organization. Consultado el 16 de marzo de 2021 de https://www.who.int/reproductivehealth/publications/infertility/9789241547789/en/
Zhou, Q. y Griswold, M. (2008). Regulation of spermatogonia. Cambridge: Harvard Stem Cell Institute. Consultado el 16 de marzo de 2021 de https://www.ncbi.nlm.nih.gov/books/NBK27035/doi: 10.3824/stembook.1.7.1
Imagen de portada
Escalona, R. (2019). Estructura del túbulo seminífero [fotografía].
Escalona, R., Larqué, C. y Sánchez, M. (2021). Gametogénesis masculina: espermatogénesis y espermiogénesis. Unidades de Apoyo para el Aprendizaje. CUAIEED/Facultad de Medicina-UNAM. (Vínculo)