Las células de la cresta neural son una población de células migratorias que contribuyen a la formación de múltiples tejidos y órganos durante el desarrollo embrionario de los vertebrados.
En la siguiente unidad, describiremos la importancia de conocer el origen embrionario de las células de la cresta neural, las rutas migratorias y los procesos que siguen para formar las estructuras definitivas del cuerpo humano.
Las células de la cresta neural se forman en los bordes laterales de la placa neural, a lo largo del
eje céfalo-caudal (axial) del embrión en desarrollo. Durante la tercera semana ya se ha definido la
región craneal y del tronco, y a la quinta, éstas se han dividido en distintas subpoblaciones de
acuerdo con su origen axial: craneal o cefálica, vagal y cardíaca, o del tronco y sacra; asimismo,
tienen distintos patrones de migración y una gran plasticidad para diferenciarse de acuerdo con las
señales ambientales, aunque esta capacidad depende del tipo de subpoblación que se trate. A
continuación se muestran las regiones de la cresta neural.
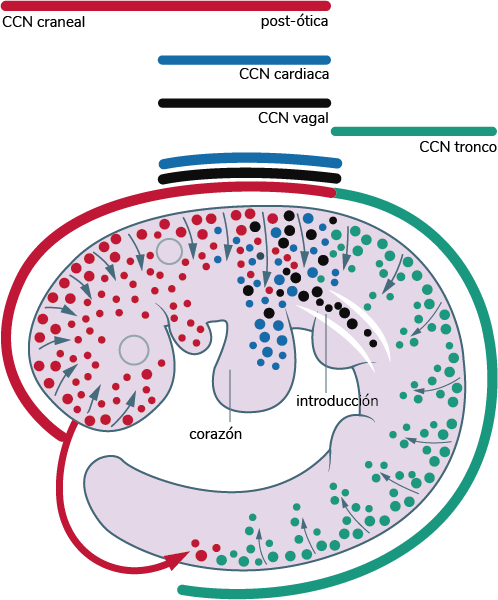
Elaboración propia, con base en Soldatov, R. et ál. (2019). Estructura espacio-temporal de las
decisiones del destino celular en la cresta neural murina Ruslan [esquema]. Tomado de
https://science.sciencemag.org/content/364/6444/eaas9536
Identificar a la cresta neural como la cuarta capa germinativa, mediante la descripción de sus principales regiones y sus vías de migración, para el conocimiento de sus derivados en el embrión y el feto.
Las células derivadas de la cresta neural (CN) se consideran la cuarta hoja blastodérmica, y representan una población celular multipotente, ya que mantienen un potencial de autorrenovación y diferenciación (Hall, 1999), así como una gran capacidad de migración y de diferenciación con los melanocitos, derivados óseos y células nerviosas (Gilbert, 2005).
Es importante conocer las tres subdivisiones del ectodermo en la etapa de así como sus derivados. Al final de la el ectodermo se subdivide en tres dominios:
1. La placa neural (NP)
2. El ectodermo no neural (ENN)
3. El borde de la placa neural (BPN)
La NP da lugar al sistema nervioso central (SNC), y el ENN, a la epidermis, respectivamente; mientras
que en el BPN se determina la cresta neural (CN), la cual origina diferentes derivados neurales,
óseos, endocrinos y melanocitos. Las placodas ectodérmicas (PE) de la región cefálica poseen
características y una potencialidad similar a las de la cresta neural, ya que se forman en la misma
región, en donde ambos precursores interaccionan (Vega et ál., 2018).
La CN craneal da lugar a los odontoblastos, el cartílago, hueso y tejido conectivo, y contribuye a los
ganglios craneales; mientras que las CN del tronco se diferencian en las células simpatoadrenales,
neuronas sensoriales y glía, y las células pigmentarias. Las PE originan los órganos de los sentidos
pareados (epitelio olfatorio, oído interno y lentes), así como el sistema nervioso periférico de la
cabeza (ganglios de los pares nerviosos craneales).
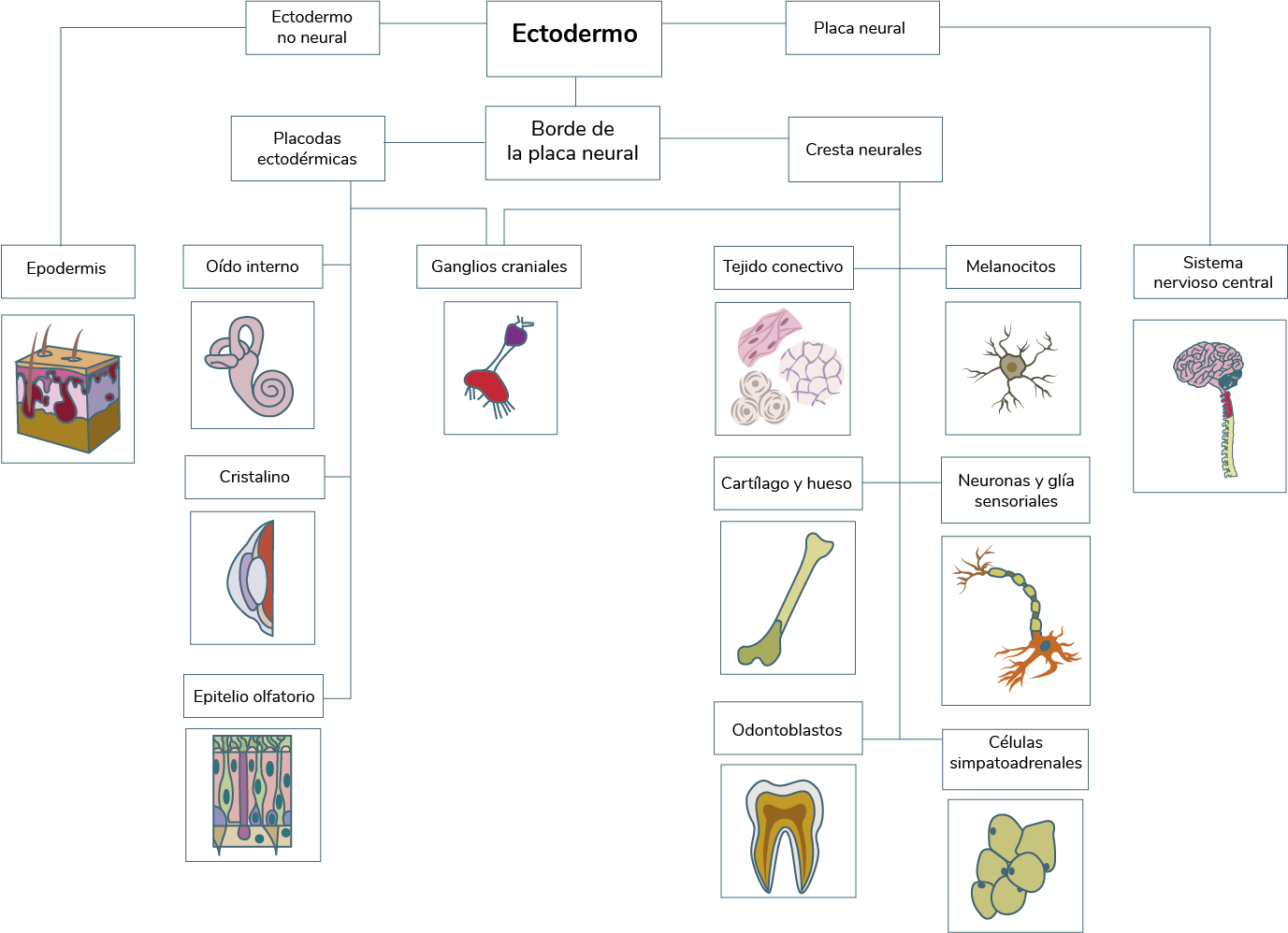
Elaboración propia, con base en Bae y Saint. (2014). Las tres subdivisiones del ectodermo en la
neúrula y sus derivados [esquema]. Tomado de
https://www.sciencedirect.com/science/article/pii/B9780124017306000028
Las células de la cresta neural (CCN) expresan un programa genético muy regulado para generar los diversos tipos celulares y, además, usan señales celulares y extracelulares para migrar desde su origen embrionario hasta su sitio de proliferación, diferenciación, sobrevivencia y función definitiva. Esta capacidad de movilidad, invasión, proliferación y pluripotencia de las CCN, que caracterizan a la embriogénesis, son atributos que también comparten con la metástasis de los tumores.
Las CCN tienen una ruta de desarrollo controlada que conduce a la mientras que las células tumorales que sobreviven a la migración muestran una proliferación y crecimiento sin regulación, la cual resulta en la metástasis (ver imagen Desarrollo de la cresta neural) (Maguire, Thomas y Goldstein, 2015).
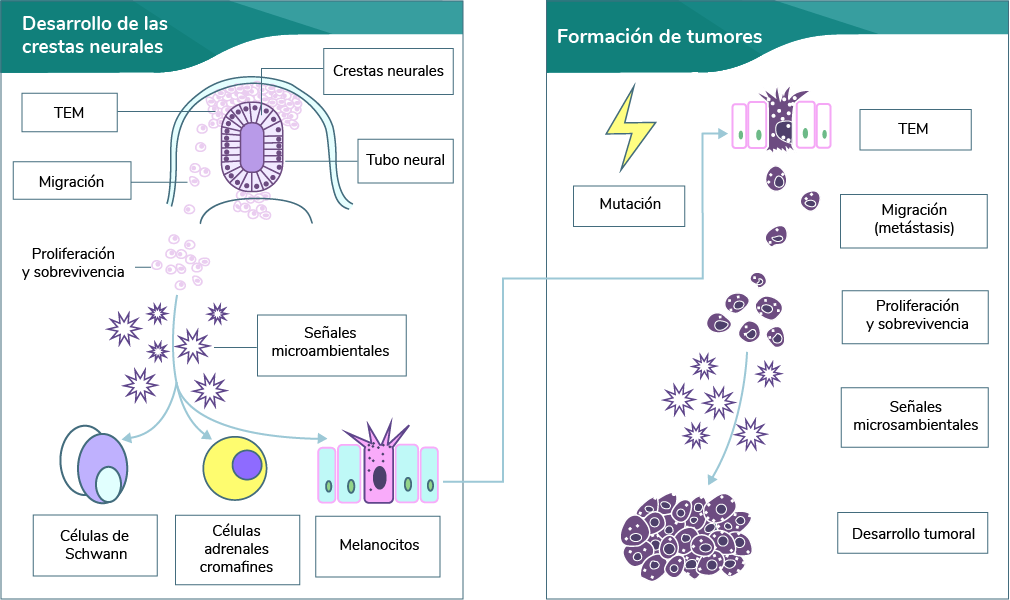
Elaboración propia, con base en Maguire, L. Thomas, A. y Goldstein, A. (2015). Desarrollo de la
cresta neural [esquema]. Tomado de https://doi.org/10.1002/dvdy.24226
Las CCN, al considerarse células troncales (multipotenciales), podrían darnos la oportunidad de investigar sus posibles aplicaciones terapéuticas en la medicina regenerativa, por ejemplo, en el paladar hendido y en algunas alteraciones cardíacas (Achilleos y Trainor, 2012; Jones y Trainor, 2004). Los recientes descubrimientos de los derivados de las CCN y los mecanismos moleculares que utilizan han servido para explicar la etiopatogenia de diversos síndromes en el humano, así como hacer diagnósticos y tratamientos adecuados (Vega et ál., 2018, p. 112).
Durante la neurulación, los pliegues neurales se elevan en el límite entre el ectodermo neural y no neural,
y después se unen en la línea media para formar el tubo neural. La cresta neural está presente en los
pliegues neurales, y en este estado premigratorio poseen un fenotipo epitelial, caracterizado por
uniones célula-célula muy fuertes y una polaridad apical-basal. Antes de iniciar su migración a lo largo de
rutas definidas, las CCN deben experimentar una transición epitelio-mesénquima (TEM), en la que pierden sus
contactos célula-célula y su polaridad, alteran su citoesqueleto de actina y adquieren un fenotipo
migratorio (delaminación). Con el inicio de la TEM, las células son capaces de delaminarse del tubo neural e
iniciar su migración por rutas establecidas durante la evolución, dirigidas por las interacciones y señales
microambientales de la matriz extracelular (lámina basal, fibronectina y colágena tipo IV), para llegar a
sus sitios de destino en el embrión. Durante su migración, las células de la cresta neural son muy
sensibles a las moléculas de orientación, la mayoría de las cuales son inhibidoras (robo/slit,
neuropilina/semaforina y efrina/Eph); asimismo, las CCN experimentan una proliferación masiva para generar
suficientes precursores celulares y poblar sus sitios blancos. Subsecuentemente, se inhiben los factores de
pluripotencia cuando alcanzan su destino (Simões y Bronner, 2015).
A continuación, te mostramos un ejemplo de cómo se lleva a cabo el desarrollo inicial de la CN en un
embrión de pollo:
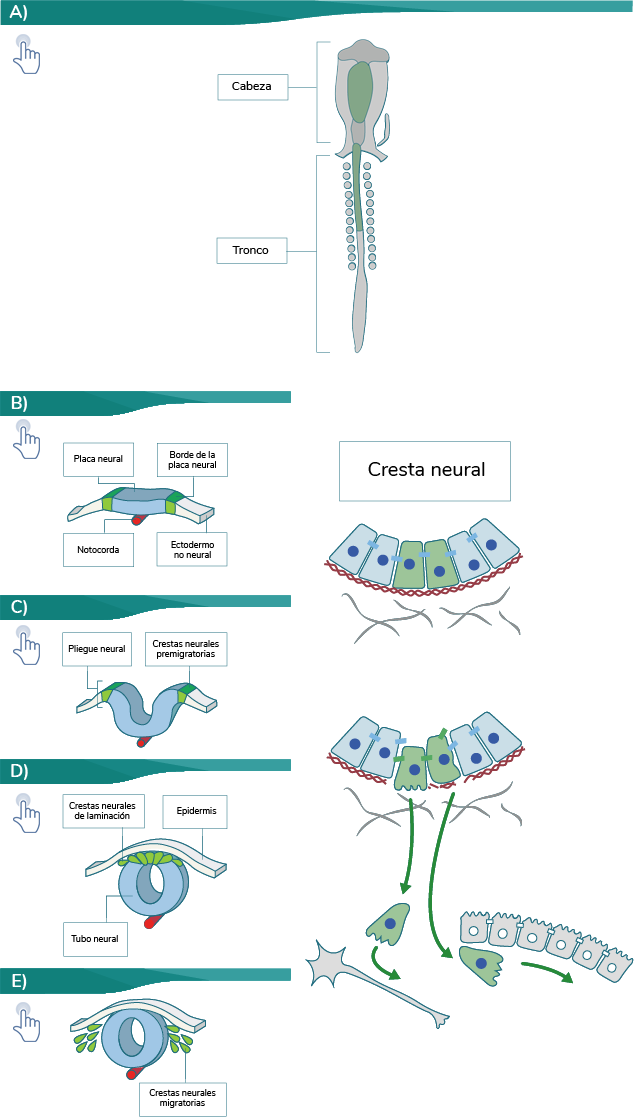
Elaboración propia, con base en Simões y Bronner. (2015). Regiones de la cresta neural craneal y
del tronco [esquema]. Tomado de https://dev.biologists.org/content/develop/142/2/242.full.pdf
Es importante que identifiques la manera en que se origina la cresta neural, ya que de ésta se formarán derivados neurales, óseos y melanocitos, en sus principales divisiones (craneal y tronco) y sus rutas de migración.
Es fundamental que conozcas que la cresta neural se regionaliza desde el prosencéfalo hasta la futura
región sacra. En el embrión de la tercera semana del desarrollo, se puede subdividir en la cresta
neural de la región del cráneo y del tronco (ver imagen Desarrollo inicial de la CN), y en el
desarrollo se va subdividiendo: las CCN del cráneo se dividen en cresta neural craneal y
circunfaríngea, y la cresta neural del tronco se subdivide en las regiones torácicas, lumbares y
sacras (Carlson, 2014; Gilbert, 2005).
A continuación, te presentamos un diagrama de las divisiones de la cresta neural en un embrión de
pollo de la etapa HH16:
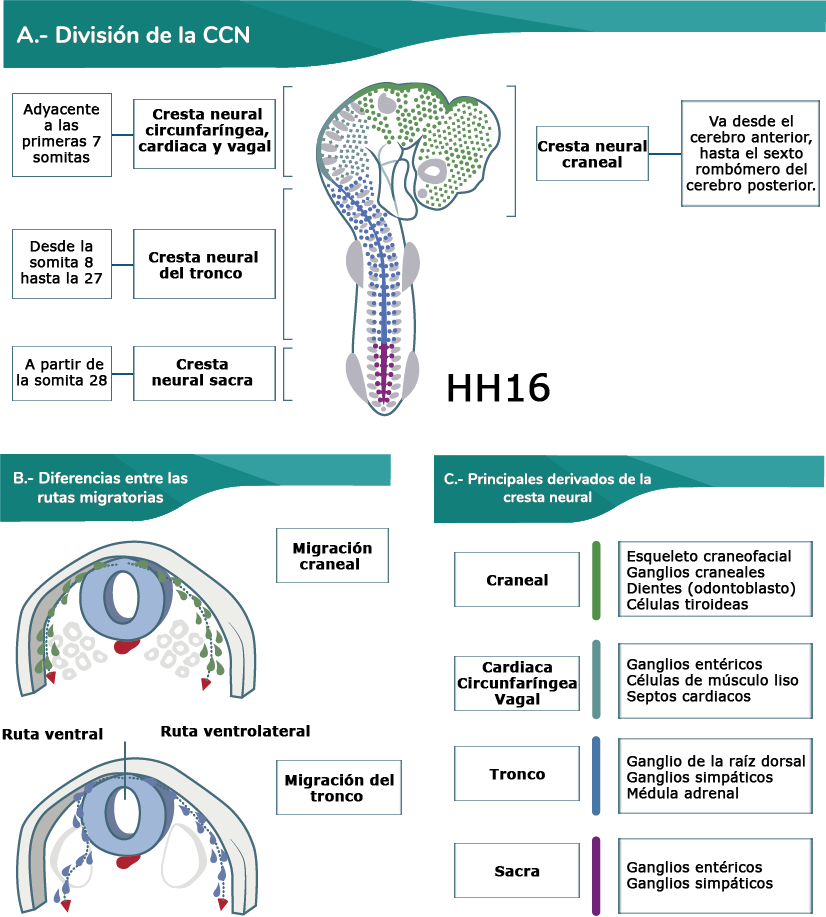
Elaboración propia, con base en Rothstein, M., Bhattacharya, D. y Simoes, M. (2018).
Descripción general de las subpoblaciones de cresta neural a lo largo del eje
anteroposterior [esquema]. Tomado de https://doi.org/10.1016/j.ydbio.2018.07.026
En el diagrama se visualizan los derivados que se formaron de las células de la cresta neural, así
como la comparación de las rutas migratorias del cráneo y del tronco.
En el cráneo, hay una ruta migratoria de la región dorsal a la parte ventral, y dos ondas u oleadas de
migración (la primera antes del cierre del tubo neural y segunda después del cierre). En el tronco,
hay tres rutas de migración (dorsal al dermatomo, ventrolateral al esclerotomo, y ventral a las
estructuras mediales).
En la siguiente tabla te presentamos los diferentes tipos celulares que se forman a partir de las
células de la cresta neural de las diferentes regiones de ésta:
|
Tabla de derivados de las células de la cresta neural |
|||
|
Región |
Subtipo |
Tejidos |
Tipos celulares |
|
Craneal |
Craneal (primera oleada de migración) |
Arcos faríngeos |
Viscerocráneo: osteocitos odontoblastos |
|
Craneal (segunda oleada de migración) |
Aparato sensorial de la nariz |
Epitelio olfatorio |
|
|
Tejido conectivo de leptomeninges |
Aracnoides y piamadre |
||
|
Pares craneales mixtos |
V VII IX y X |
||
|
Ojo |
Córnea |
||
|
Oído |
Externo(cartílago) |
||
|
Hipófisis |
Pericitos de la vascularización |
||
|
Circunfaríngea |
Vagal (inervación vagal) |
Inervación entérica, timo y tiroides |
|
|
Cardíaca (tracto de salida del corazón) |
Aorta ascendente (pared) |
||
|
Células pigmentarias |
Piel del cráneo |
Melanocitos |
|
|
Tronco |
Torácicas |
Ganglios sensitivos |
Neuronas sensitivas, entéricas, colinérgicas y adrenérgicas |
|
Adrenales |
Médula (cromafines) |
||
|
Sacras |
Inervación entérica del colon descendente |
Neuronas (sensitivas y autónomas parasimpáticas) |
|
|
Células pigmentarias |
Piel del tronco |
Melanocitos |
|
Elaboración propia, con base en Bae y Saint. (2014). Tabla de derivados de las células de la cresta neural [tabla]. Tomado de https://doi.org/10.1016/B978-0-12-401730-6.00002-8
La cresta neural tiene dos principales divisiones a lo largo del tubo neural (en la tercera semana de su desarrollo), y, posteriormente, se subdivide y migra para dar lugar a diferentes tipos celulares y de tejidos.
Para adentrarte en el proceso de diferenciación, es indispensable que conozcas que, en la región del tronco, las subpoblaciones de las CCN forman diferentes grupos o linajes, ya que siguen tres rutas de migración: una ventral que da origen a las células simpatoadrenales, la ventrolateral que origina neuronas sensitivas, y la dorsal para células melanocíticas (ver animación Migración CCN del tronco). A continuación te presentamos los tipos de linajes:
En la región del tronco, las subpoblaciones de las CCN forman diferentes grupos o linajes, ya que siguen tres rutas de migración: una ventral que da origen a las células simpatoadrenales, la ventrolateral que origina las neuronas sensitivas, y el dorsal para las células melanocíticas; como se muestra en la siguiente animación de la migración CCN del tronco, representada en un embrión de pollo.
Elaboración propia, con base en Staveley, B. (s. f). Las células de la cresta neural
migran [esquema]. Tomado de
http://www.mun.ca/biology/desmid/brian/BIOL3530/DB_07/DBNMorph.html
A continuación te presentamos los tipos de linajes de las rutas de migración del tronco:
a. Migración de las crestas neurales: linaje melanocítico, dorsal; linaje sensorial, ventrolateral, y linaje autónomo simpatoadrenal, ventral (también se muestra el proceso).
b. Neurogénesis sensitiva.
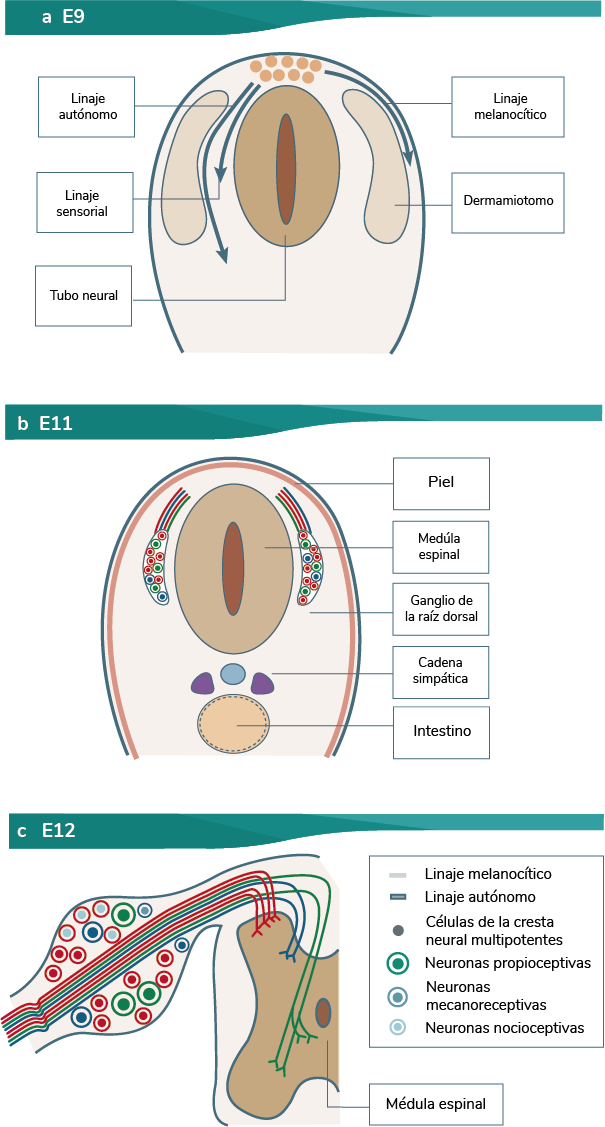
Elaboración propia, con base en Marmigère y Ernfors. (2007). Migración de la cresta neural,
neorogénesis sensorial y el establecimiento de cinexiones específicas de modalidad
[esquema]. Tomado de https://www.nature.com/articles/nrn2057.pdf
Para sintetizar, considera que cada uno de los tres tipos de linajes origina diferentes células, tal como se muestra en la siguiente tabla:
| Cresta neural del tronco | ||
|
Tres rutas de migración |
Linaje |
Originan |
|
Ventral |
Simpático adrenal |
- Células cromafines suprarrenales. |
|
Ventrolateral |
Sensitivo o sensorial |
- Ganglios sensitivos: raíces dorsales. |
|
Dorsal |
De los melanocitos |
Sólo produce un tipo celular. |
Elaboración propia, con base en Carlson, B. (2014). Rutas de migración de la cresta neural del tronco [tabla]. Tomada de https://aprobemosjuntos.files.wordpress.com/2018/03/embrio-carlson.pdf
Es un componente principal del extremo cefálico del embrión. Los estudios comparativos sobre el
desarrollo y la anatomía indican que la cresta neural craneal puede representar el principal
sustrato morfológico para la evolución de la cabeza de los vertebrados. La mayoría de
los estudios sobre esta estructura se han realizado en embriones de aves, pero parece que las
propiedades y el papel de la cresta neural son bastante similares en el desarrollo craneal de los
mamíferos.
Existen dos ondas de migración de las células de la cresta neural craneal.
Para que las conozcas mejor, en seguida las describimos con mayor detalle:
En el cráneo, las células de la cresta neural abandonan el futuro encéfalo mucho antes del cierre de los pliegues neurales (ver imagen Células de la cresta neural craneal inciso A). En la zona del prosencéfalo, migran para formar el proceso frontonasal y el tejido conectivo del ojo, y en la región del prosencéfalo, las CCN (ver imagen CNN craneal incisos B y C). Son oleadas específicas de células de la cresta neural que surgen del rombencéfalo, y que contribuyen al desarrollo de los primeros tres arcos faríngeos (ver imagen CNN craneal inciso C) (Gilbert, 2005). Aunque estas oleadas de las CCN no están aún diferenciadas, existe un orden muy específico espaciotemporal en estas vías con destino para el desarrollo del viscerocráneo (Carlson, 2014).
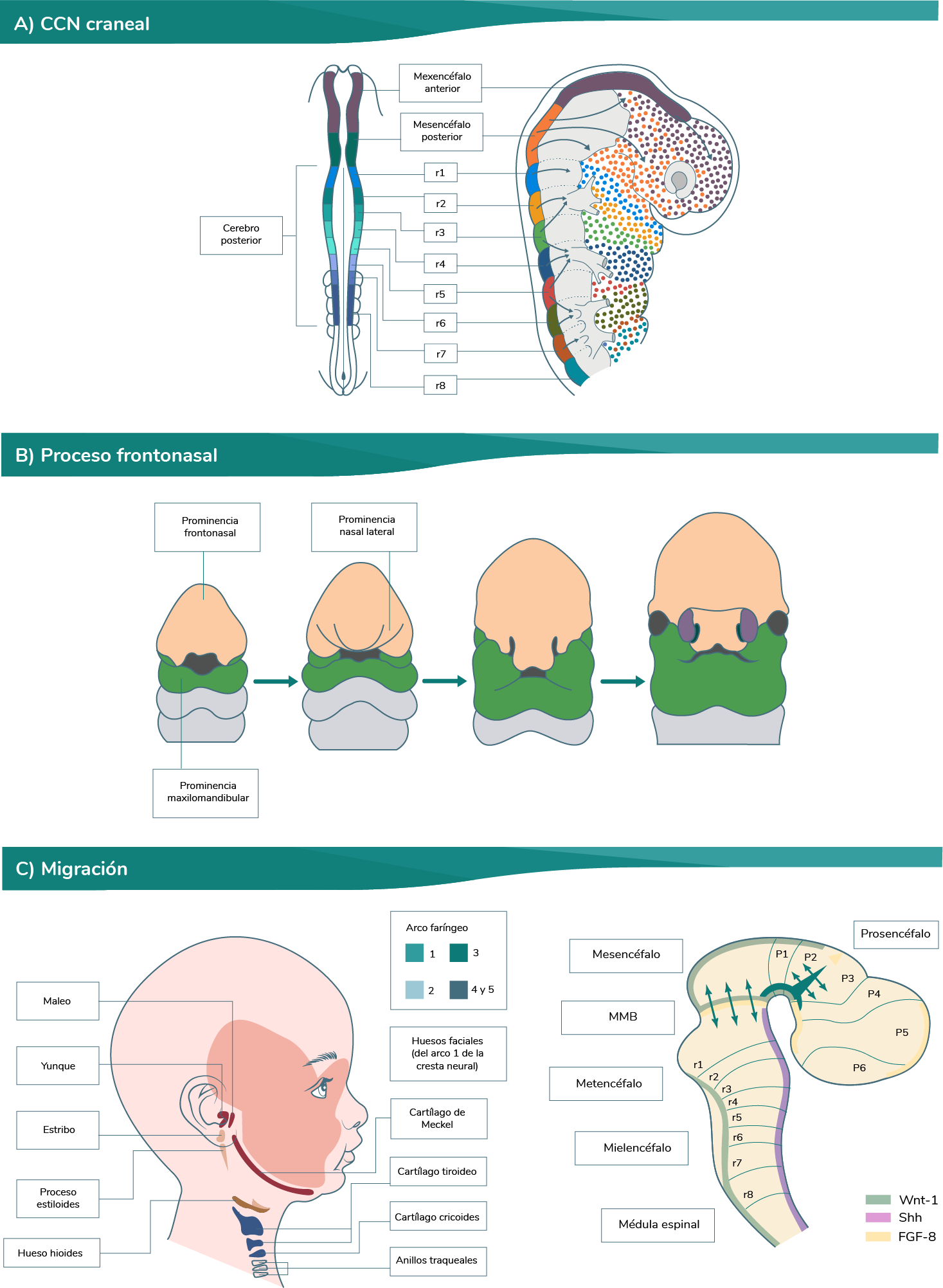
Elaboración propia, con base en Gilbert, S. (2005). Células de la cresta neural craneal
[esquema]. Tomado de https://www.ncbi.nlm.nih.gov/books/NBK9983/
La siguiente imagen es del encéfalo de un embrión de vertebrado, en ésta se muestra la segmentación del rombencéfalo (rombómeros [r]) y del prosencéfalo (prosómeros [P]), así como la distribución de las principales moléculas de transmisión de señales.
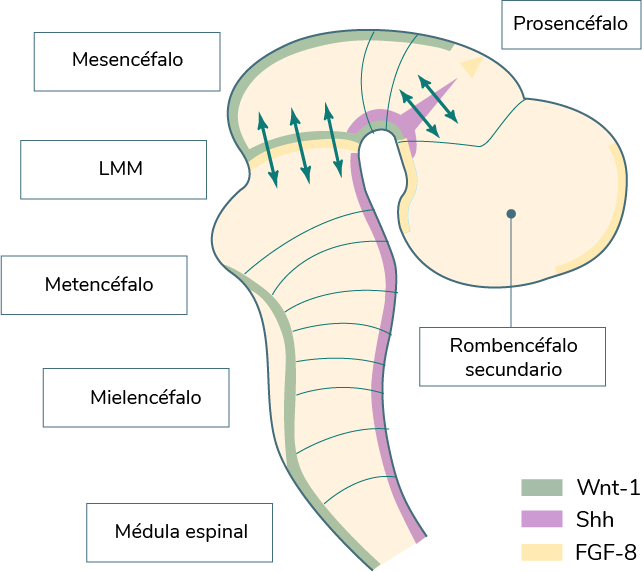
Elaboración propia, con base en Cuif, B. y Wassef, M. (1995). Embriología humana y bilogía del
desarrollo [esquema]. p. 226. Tomado de
https://aprobemosjuntos.files.wordpress.com/2018/03/embrio-carlson.pdf
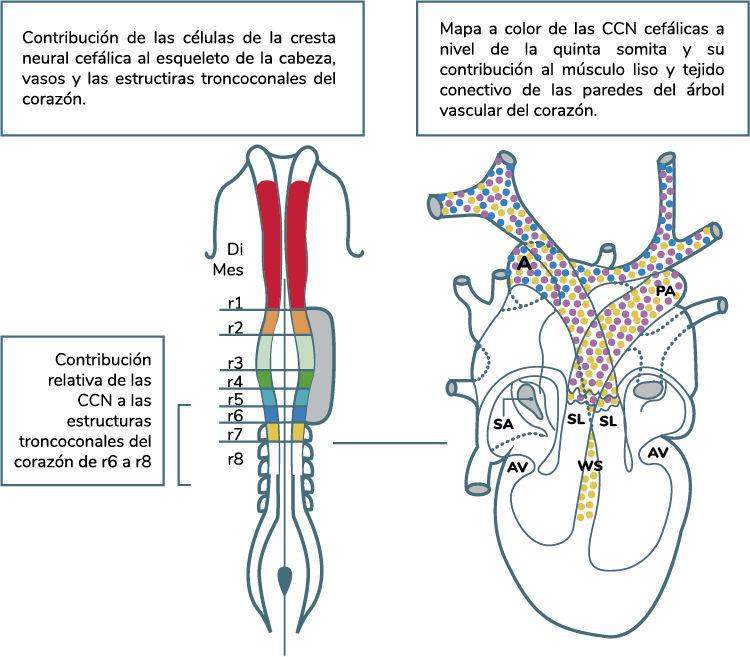
Las células de la cresta neural asociadas a los rombómeros r1 y r2 migran hacia el interior del primer
arco faríngeo (a partir del cual forman el viscerocráneo y la cavidad del oído medio, yunque y
martillo); del rombómero r4 lo hacen hacia el segundo arco (estroma de la amígdala palatina), y de los
rombómeros r6 y r7 llegan al tercer arco (estroma de la paratiroides inferior y el timo).
Se sabe que algunas de las células de la cresta neural asociadas a r3 y r5 van por la vía de la
apoptosis; además, las investigaciones recientes han demostrado que el mesénquima de somitómeros
ejerce un efecto de repulsión sobre las células de la cresta neural que tratan de penetrar en estas
regiones. Algunas células de la cresta neural originadas en r3 que sobreviven se dividen en pequeñas
corrientes, las cuales penetran en los arcos faríngeos primero y segundo; mientras que las derivadas
de r5 se comportan también de un modo parecido y se mezclan con las corrientes celulares originadas en
r4 y r6.
Las células de la cresta neural craneal en emigración consisten en una mezcla de células cuyo
destino ya ha sido fijado, y otras cuyo destino está determinado en gran medida por su entorno. A
medida que se alejan del encéfalo, las células de la cresta craneal migran rostralmente en grupos (en
la zona de la faringe), en la vía dorsal, directamente bajo el ectodermo (ver imágenes: CCN
craneal, proceso frontonasal y migración).
Ahora, se describirá qué sucede durante la segunda onda de migración de las células de la cresta
neural del cráneo, que incluye la interacción con las placodas ectodérmicas (pares craneales) y las
circunfaríngeas (cardíaca y vagal).
A medida que la región craneal comienza a tomar forma, aparecen varias series de placodas
ectodérmicas en la parte lateral del tubo neural y de la cresta neural. Las placodas
ectodérmicas son engrosamientos transitorios localizados en el ectodermo de la región cefálica
y en el cuello, las cuales proceden de un dominio preplacoda en forma de herradura, situado en
posición anterior a la placa neural que se estableció durante la gastrulación y el inicio de la
neurulación (ver imagen Formación de las placodas).
Las placodas ectodérmicas son el resultado de una variedad de procesos inductivos secundarios entre
los tejidos neural y mesenquimatoso, así como del ectodermo superficial. La cresta neural craneal y
las placodas craneales pueden haberse originado desde la misma población celular durante la evolución
temprana de los vertebrados. Asimismo, las células de las placodas ectodérmicas y de la cresta neural
muestran una interacción estrecha para formar los ganglios sensitivos de los pares craneales (V, VII,
IX y X).
A continuación, te presentamos las fases iniciales en la formación de las placodas ectodérmicas
craneales en el embrión de pollo, contempladas desde la parte dorsal (en el esquema las placodas
aparecen en azul).
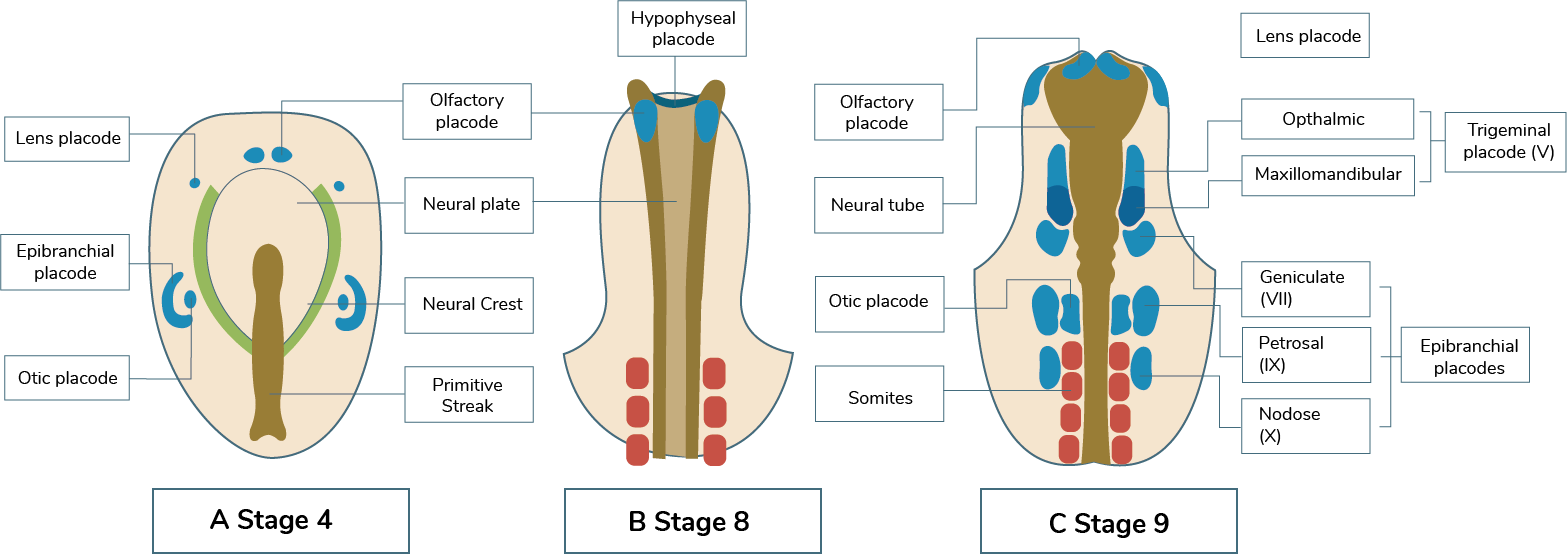
Elaboración propia, con base en Carlson, B. (2014). Fases de la formación de las placodas
ectodérmicas craneales en el embrión de pollo, contempladas desde la parte dorsal
[esquema]. Tomado de https://aprobemosjuntos.files.wordpress.com/2018/03/embrio-carlson.pdf
Las placodas ectodérmicas sensoriales craneales son componentes críticos del sistema nervioso que dan
origen al aparato sensorial de la nariz, oídos y receptores del gusto, así como el cristalino del ojo
(a diferencia de los otros componentes, no es un receptor sensorial).
Las placodas ectodérmicas sensitivas, junto con las células de la cresta neural craneal, en la segunda
onda de migración no llegan hasta la región a los arcos faríngeos, sino que migran dorsalmente para
formar células gliales. Esta glía forma los senderos que guían a las neuronas desde las placodas
epibranquiales hacia el cerebro posterior. Las conexiones producidas por estas neuronas permiten que
se perciba el gusto y otras sensaciones faríngeas. Por lo tanto, las células gliales producidas por la
segunda onda de migración de la cresta neural craneal son críticas en la organización de la inervación
del cerebro posterior, el cual corresponde a los pares craneales VII, IX y X (Carlson, 2014).
|
Tabla de las placodas ectodérmicas y sus derivados |
|
|
Placoda ectodérmica |
Derivado |
|
Estructural |
|
|
Neurogénicas |
|
|
Trigémino |
Ganglios del trigémino (V) |
|
Glandular o secretora |
|
Elaboración propia, con base en Begbie y Graham. (2001). Placodas ectodérmicas y sus derivados [tabla]. Tomada de https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1088542/pdf/TB011655.pdf
En la siguiente imagen se muestra la posición de origen y destino de las placodas ectodérmicas en un embrión de pollo; así como sus sitios de origen con relación al tubo neural formados durante la segunda oleada de migración.
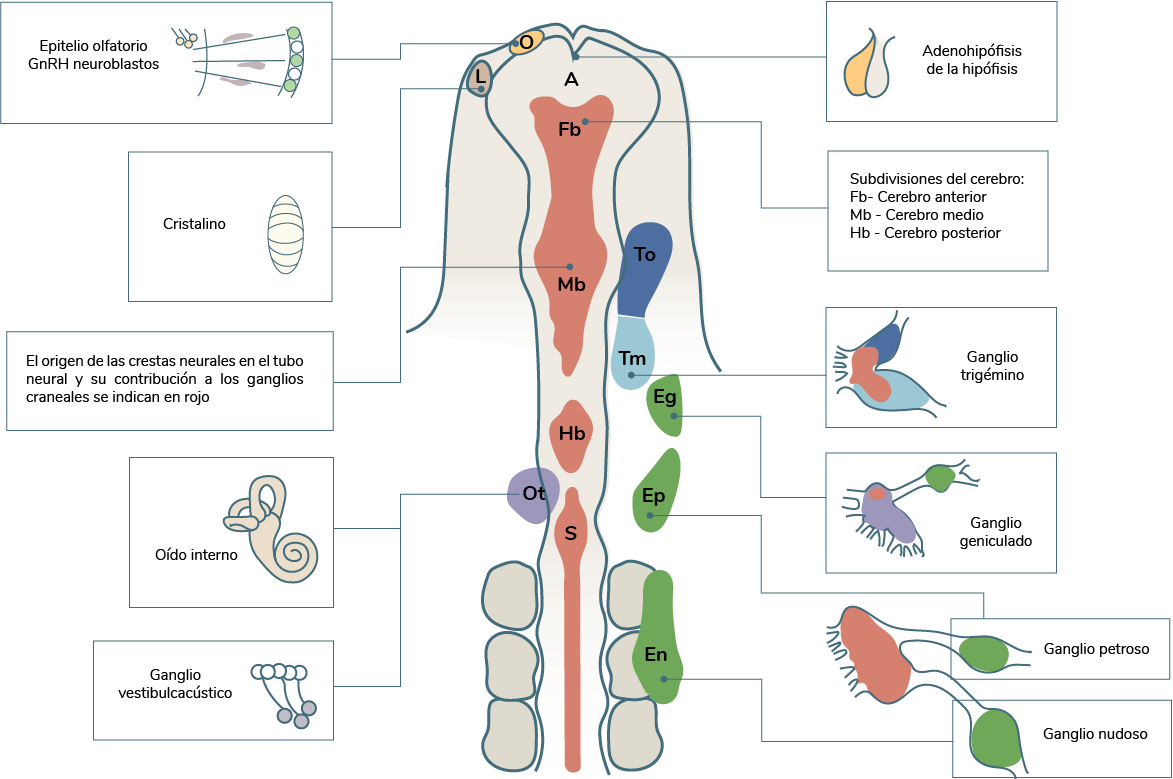
Elaboración propia, con base en Mason, I. (2007). Funciones de las placodas FGF propuestas
[esquema]. Tomado de https://europepmc.org/abstract/med/17637802
La cresta neural circunfaríngea surge en la región posterior del rombencéfalo, en los niveles de las
somitas 1 a 7. Esta región de la cresta neural representa una transición entre la cresta neural
craneal y la del tronco, y se le considera una cresta neural craneal. Las células resultantes en los
niveles de las cuatro primeras somitas se comportan más como cresta craneal (con sólo una ruta de
migración); mientras que el flujo migratorio a nivel de las somitas 5 a 7 sigue caminos más
característicos de la cresta del tronco (con tres rutas de migración).
La cresta circunfaríngea es un agregado celular en forma de arco que pasa por detrás del sexto
arco branquial. Las CCN migran hacia la región ventral de la faringe, y proporcionan una vía a través
de la cual pasan el nervio hipogloso (XII) y sus precursores asociados del músculo esquelético. La
mayoría de las células de la cresta neural entre las somitas 1 y 3 migran, ya sea al tracto de salida
del corazón o al cuarto y sexto arcos branquiales; además, estas células constituyen la cresta
cardíaca. Otras células de este nivel, así como las derivadas del nivel de las somitas 4 a 7,
forman la cresta vagal.
Estas células migran hacia el intestino como precursoras de la inervación parasimpática del tracto
digestivo. Asimismo, forman neuronas sensitivas y glía, así como alguna contribución a los ganglios
simpáticos. La mayoría de las células de la cresta cardíaca migran a lo largo de la vía dorsolateral,
entre las somitas y el ectodermo; mientras que los de la cresta vagal, como los del tronco, migran
inicialmente a lo largo de las vías ventrales, entre el tubo neural y el dermomiotomo (ver imagen CCN
cardíaca) (Carlson, 2014).
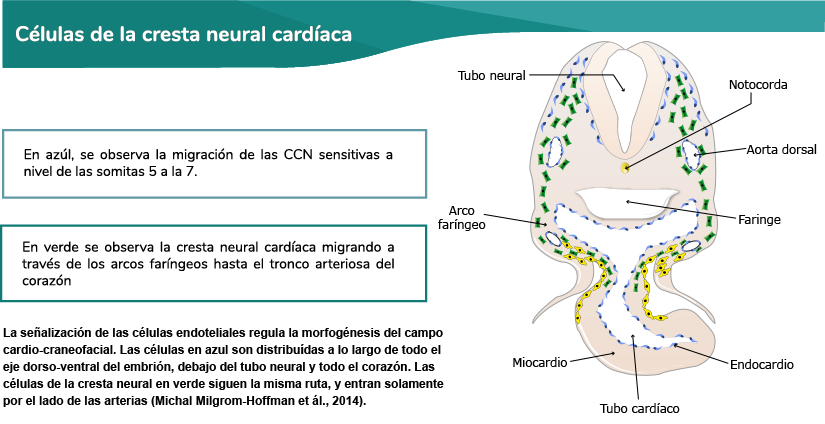
Elaboración propia, con base en Milgrom et ál. (2014). La señalización de células endoteliales
regula la morfogénesis del campo cardio-craneofacial [esquema]. Tomado de
https://bio.biologists.org/content/3/8/679
La cresta cardíaca contribuye enormemente a la formación de las crestas troncoconales que separan el tracto de salida del corazón en la aorta y los segmentos pulmonares (ver imagen derivados de la CCN cardíaca y cresta neural cefálica); así mismo, contribuyen a las valvas de las válvulas semilunares en la base de la vía de salida. La cresta neural cardíaca puede interactuar con el endodermo faríngeo para modificar las señales que conducen a la diferenciación normal de las células del miocardio. Además, están descritas dos oleadas o migraciones dorsolaterales de las células de la cresta neural cardíaca que salen del tubo neural. La migración más temprana contribuye principalmente al tracto de salida cardíaco y arterias del cayado aórtico, mientras que las células de la migración más tardía se incorporan a las glándulas faríngeas (Carlson, 2014).
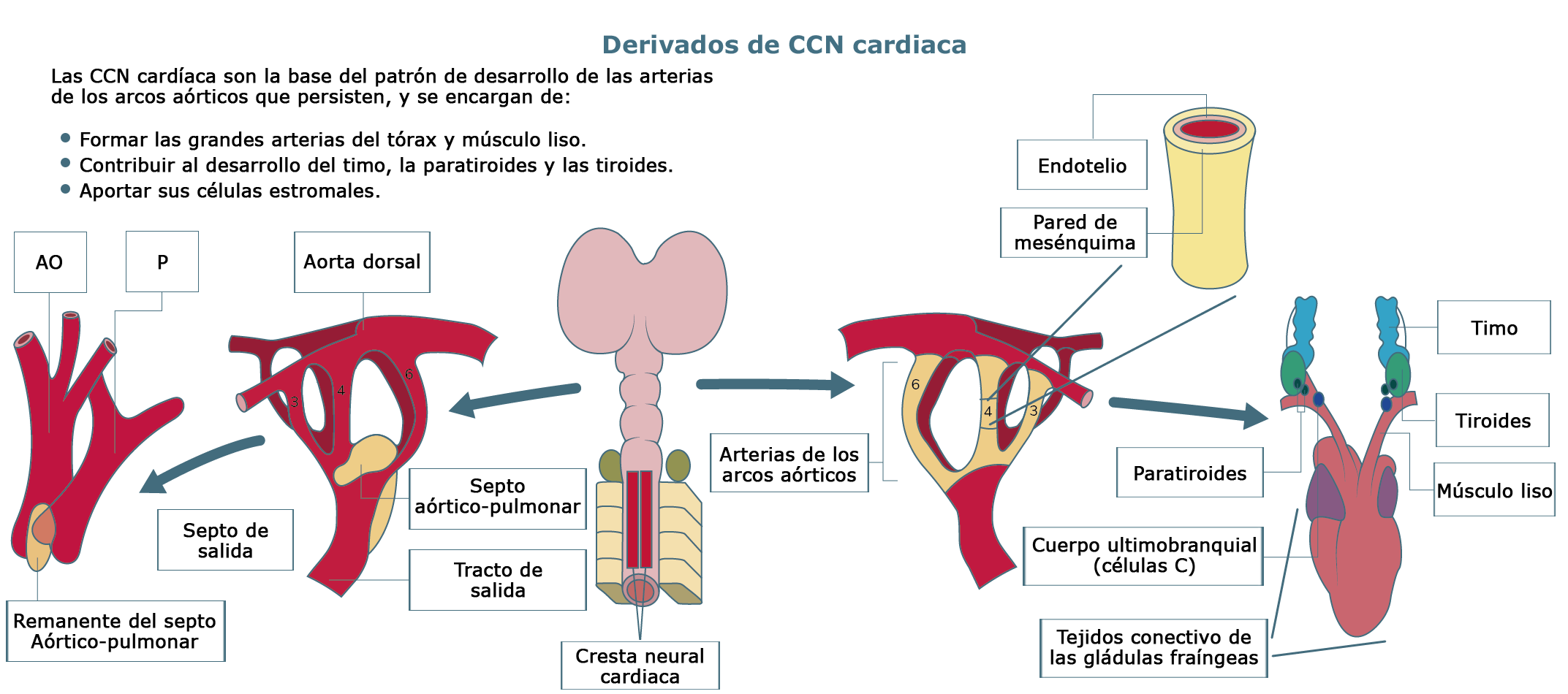
Elaboración propia, con base en Kirby y Hutson. (2010). Derivados de CCN cardíaca
[figura]. Tomada de https://doi.org/10.1016/j.diff.2012.04.005
Elaboración propia, con base en Etchevers et ál. (1999), y Etchevers et ál. (2001). Neural
crest cell plasticity and its limits [equema]. Tomado de
https://dev.biologists.org/content/131/19/4637
Algunas células de la cresta neural migran ventralmente a la faringe, en los flujos bilaterales que
acompañan a los mioblastos derivados de las somitas, y se desplazan cranealmente para formar los
músculos intrínsecos de la lengua y los músculos de la hipofaringe. Este es el único caso conocido en
el que los músculos derivados de las somitas se relacionan con el tejido conectivo derivado de la
cresta neural. Asimismo, la cresta neural cardíaca también origina a las células de Schwann,
las cuales están presentes en el hipogloso y otros nervios craneales.
Una alteración en esta región de la cresta neural puede causar defectos de los septos cardíacos
(septo aórtico-pulmonar), así como malformaciones craneofaciales y de las glándulas tiroides y
timo (síndrome de DiGeorge).
Las células de la cresta neural existentes en el tubo digestivo forman el denominado sistema
nervioso entérico. El número de las neuronas entéricas se aproxima al existente en la médula
espinal. Esta independencia explica la razón de que el intestino pueda mantener su actividad refleja
aún en ausencia de las aferencias directas del sistema nervioso central.
Las células que forman las neuronas del sistema nervioso entérico proceden de la cresta circunfaríngea
conocida como cresta vagal. Estas células salen de los niveles de los somitos 1 a 7, siguen una vía
ventral a través de la parte dorsal de la cresta circunfaríngea, y posteriormente salen de esta vía
caudal al arco branquial. La mayoría de estas células se vuelven estrechamente asociadas con el
intestino embrionario, pero algunas están implicadas en la formación de los ganglios sensitivos de la
raíz dorsal del nervio espinal y la glía asociada.
En el nivel del somito 7, algunas células aún contribuyen a los ganglios simpáticos locales de esa
zona. Las células de la cresta neural no están comprometidas a formar el tejido nervioso asociado al
intestino antes de que abandonen la médula espinal.
Bajo la influencia del factor neurotrófico derivado de la glía (GDNF), las células de la cresta
vagal entran en la región rostral del intestino anterior y comienzan a poblar el mismo.
Dentro de la pared del intestino, las células de la cresta vagal se extienden a lo largo del
intestino, deteniéndose cerca del extremo caudal del mismo en la séptima semana del desarrollo. Los
precursores neuronales derivados de las células de la cresta vagal, que más tarde serán neuronas
parasimpáticas, avanzan en forma de hileras interconectadas mientras siguen proliferando.
El avance de este frente se debe a la proliferación y ocupación de una región despoblada del
intestino, más que a una migración dirigida de las células individuales. Cuando el frente de avance
llega al ciego, las células se detienen por algunas horas debido a la presencia de determinadas
señales locales, antes de extenderse por el futuro colon. Dentro del colon, las células de la cresta
vagal contactan finalmente con un pequeño número de células emigradas de la cresta neural sacra; en
ese momento, la actividad invasiva cesa, y continúa una nueva organización de los ganglios entéricos.
Cuando colonizan por primera vez este órgano, estas células no expresan marcadores neuronales;
posteriormente se produce una onda de diferenciación a lo largo del intestino, y las células
sintetizan proteínas de los neurofilamentos y empiezan a expresar catecolaminas. Dichas células darán
origen al plexo mientérico (Carlson, 2014).
En seguida, se presenta la contribución de las CCN al sistema nervioso entérico. En este esquema del
sistema nervioso central y autónomo de un tetrápodo, se muestran tres tipos de células de la cresta
neural que se distinguen por su destino.
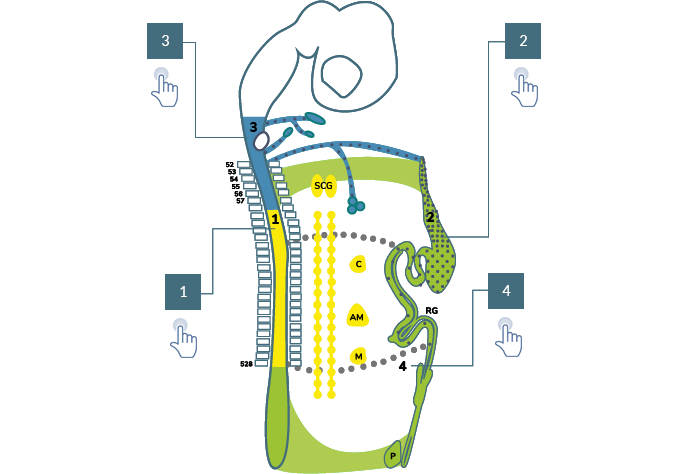
Elaboración propia, con base en Espinosa, I. et ál. (2017). CCN sistema nervioso entérico
[esquema]. Tomado de https://doi.org/10.1073/pnas.1710308114
Como te diste cuenta, es importante describir el origen y desarrollo de las CCN para entender los procesos embrionarios y la evolución de los vertebrados, ya que las CCN contribuyen en la formación de los órganos de los sentidos, el corazón tetracavitario, la inervación autónoma y las estructuras óseas de la mandíbula y el cráneo.
Con la TEM, las células son capaces de delaminarse del tubo neural, y es cuando inicia la migración por las rutas establecidas. Esta migración ayuda a determinar los procesos de diferenciación, ya que en cada una de las células se presentan características y funciones determinadas durante el desarrollo embrionario.
Como has visto, reconocer cada una de las partes que integran la división de las CCN ayuda a
comprender los procesos específicos que cada una de ellas cumple; así mismo, también permite
identificar su origen para comprender su desarrollo embrionario.
Bibliografía
His, W. (1868). Untersuchungüber die ersteanlage des Wirbeltierleibes. Die erste entwickling des
Hühnchens. Leipzig: Vogel.
Documentos electrónicos
Begbie, J. y Graham, A. (2001). The ectodermal placodes: a dysfunctional family. The Royal
Society, 356, 1655-1660 Consultado el 29 de junio 2020 de https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1088542/pdf/TB011655.pdf
García, M. (2011). Early origin and differentiation capacity of the neural crest. Topics in Animal
and Plant Development: from Cell Differentation to Morphogenesis, 55–74. India: Transword
Research Network. Consultado el 25 de julio de 2018 de https://pdfs.semanticscholar.org/7623/181ba8dafcbc43355cc93a122b5ba27886f5.pdf
Simões, M. y Bronner, M. (2015). Establishing neural crest identity: a gene regulatory recipe.
Development, 142, 242–257. Consultado el 31 de octubre de 2018 de https://dev.biologists.org/content/develop/142/2/242.full.pdf
Sitios electrónicos
Achilleos, A. y Trainor, P. (2012). Neural crest stem cells: discovery, properties and potential for
therapy. Cell Research, 22, 288–304. Consultado el 03 de agosto de 2018 de https://www.nature.com/articles/cr201211
Bae, C. y Saint, J. (2014). Cap. 2. Induction and specification of neural crest cells: extracellular
signals and transcriptional switches. Neural Crest Cells: Evolution. Development and Disease,
27–42. Londres: Elsevier. Consultado el 11 de febrero de 2020 de https://doi.org/10.1016/B978-0-12-401730-6.00002-8
Carlson, B. (2014). Cap. 12 Cresta neural. Embriología Humana y Biología del Desarrollo,
254–268. Madrid: Elsevier. Consultado el 18 de abril de 2018 de https://aprobemosjuntos.files.wordpress.com/2018/03/embrio-carlson.pdf
DiccionarioMédico.net. (2019). Gastrulación. Consultado el 15 de octubre de 2019 de https://www.diccionariomedico.net/diccionario-terminos/5910-gastrulación
DiccionarioMédico.net. (2019). Neurula. Consultado el 15 de octubre de 2019 de
https://www.diccionariomedico.net/diccionario-terminos/5321-neúrula
DiccionarioMédico.net. (2019). Organogénesis u organogenia. Consultado de
https://www.diccionariomedico.net/diccionario-terminos/5542-organogénesis-u-organogenia
Espinosa, I., Jevansb, B., Boismoreaua, F., Chettouha, F., Enomotoc, H., Müllerd, T.,… Brunet, J.
(2017). Dual origin of enteric neurons in vagal Schwann cell precursors and the sympathetic neural
crest. PNAS, 114(45), 11980–11985. Consultado el 15 de junio de 2020 de
https://www.pnas.org/content/pnas/114/45/11980.full.pdf
Gilbert, S. (2005). Cap. 13 Células de la cresta neural y especificidad axonal. Biología del
Desarrollo, 457–496. Reino Unido: Panamericana. Consultado el 01 de agosto de 2018 de
https://www.ncbi.nlm.nih.gov/books/NBK9983/
Hall, B. (1999). The Neural Crest in Development and Evolution. Springer-Verlag. Nueva York.
Consultado el 18 de abril de 2018 de
https://www.springer.com/gp/book/9781475730647
Keyte, A. y Redmond, M. (2012). The neural crest in cardiac congenital anomalies.
Differentiation, 84, 25–40. Consultado el 18 de abril de 2018 de
https://doi.org/10.1016/j.diff.2012.04.005
Maguire, L., Thomas, A. y Goldstein, A. (2015). Tumors of the neural crest: common themes in
development and cancer. Developmental Dynamics, 244, 311–322. Consultado el 25 de enero de
2019 de https://onlinelibrary.wiley.com/doi/epdf/10.1002/dvdy.24226
Marmigère, F. y Ernfors, P. (2007). Specification and connectivity of neuronal subtypes in the sensory
lineage. Nature Reviews Neuroscience, 8, 114–127. Consultado el 31 de octubre de 2018 de
https://www.nature.com/articles/nrn2057.pdf
Mason, I. (2007). Initiation to end point: the multiple roles of fibroblast growth factors in neural
development. Nature Reviews Neuroscience, 8, 583–596. Consultado el 06 de mayo de 2019 de
https://www.nature.com/articles/nrn2189
Milgrom, M., Michailovici, I., Ferrara, M., Zelzer, E. y Tzahor, E. (2014). Endothelial cells regulate
neural crest and second heart field morphogenesis. Biology Open, 3, 679–688. Consultado el 15
de junio de 2020 de https://bio.biologists.org/content/3/8/679
Jones, N. y Trainor, P. (2004). The therapeutic potential of stem cells in the treatment of
craniofacial abnormalities. Expert Opinion on Biological Therapy, 4(5), 645–657. Consultado
el 15 de junio de https://www.ncbi.nlm.nih.gov/pubmed/15155156
Le Douarin, N., Creuzet, S., Couly, G. y Dupin, E. (2004). Neural crest cell plasticity and its
limits. Development, 131, 4637. Consultado el 27 de agosto de 2018 de
https://dev.biologists.org/content/131/19/4637
Rothstein, M., Bhattacharya, D. y Simoes, M. (2018). The molecular basis of neural crest axial
identity. Developmental Biology, 444, 170–180. Consultado el 29 de noviembre de 2019 de
https://doi.org/10.1016/j.ydbio.2018.07.026
Staveley, B. (s. f). Morphogenesis: Change in Form in the Early Embryo. Consultado el 27 de enero de
2020 de http://www.mun.ca/biology/desmid/brian/BIOL3530/DB_07/DBNMorph.html
Soldatov, R., Kaucka, M., Kastrati, M. y Petersen, J. (2019). Spatiotemporal structure of cell fate
decisions in murine neural crest. Science, 364. Consultado el 11 de febrero de 2020 de
https://science.sciencemag.org/content/364/6444/eaas9536
Vega, L., Cerrizuela, S., Tribulo, C. y Aybar, M. (2018). Neuropcritopatías: nuevos conocimientos 150
años después del descubrimiento de la cresta neural. Developmental Biology, 444, 110–143.
Consultado el 07 de junio de 2020 de
https://www-sciencedirect-com.pbidi.unam.mx:2443/science/article/pii/S0012160617308382?via%3Dihub
Imagen de portada
Elaboración propia, con base en Barlow, A. y Trainor Lab. (s. f). Migrating neural crest
cells (shown in green) in a mouse embryo [imagen]. Kansas. Tomada de https://www.stowers.org/faculty/trainor-lab
Cómo citar
Aguirre, E., Velázquez, A., González, M. y Hofmann, P. (2021). Cresta neural: la cuarta capa germinativa. Unidades de Apoyo para el Aprendizaje. CUAIEED/Facultad de Medicina UNAM. (Vínculo)