En esta unidad de aprendizaje nos enfocaremos en cada fase del proceso normal del ciclo sexual femenino y su implicación en los años fértiles de la mujer. Revisaremos la interacción entre el hipotálamo y la hipófisis, los cuales promueven cambios cíclicos hormonales en el ovario. A su vez, el ovario instruye al útero, las trompas uterinas y al cérvix a prepararse para un posible embarazo. Con fines explicativos, abordaremos el ciclo de cada órgano involucrado por separado, pero recuerda que se encuentran entrelazados y, por lo tanto, responden de forma cíclica.
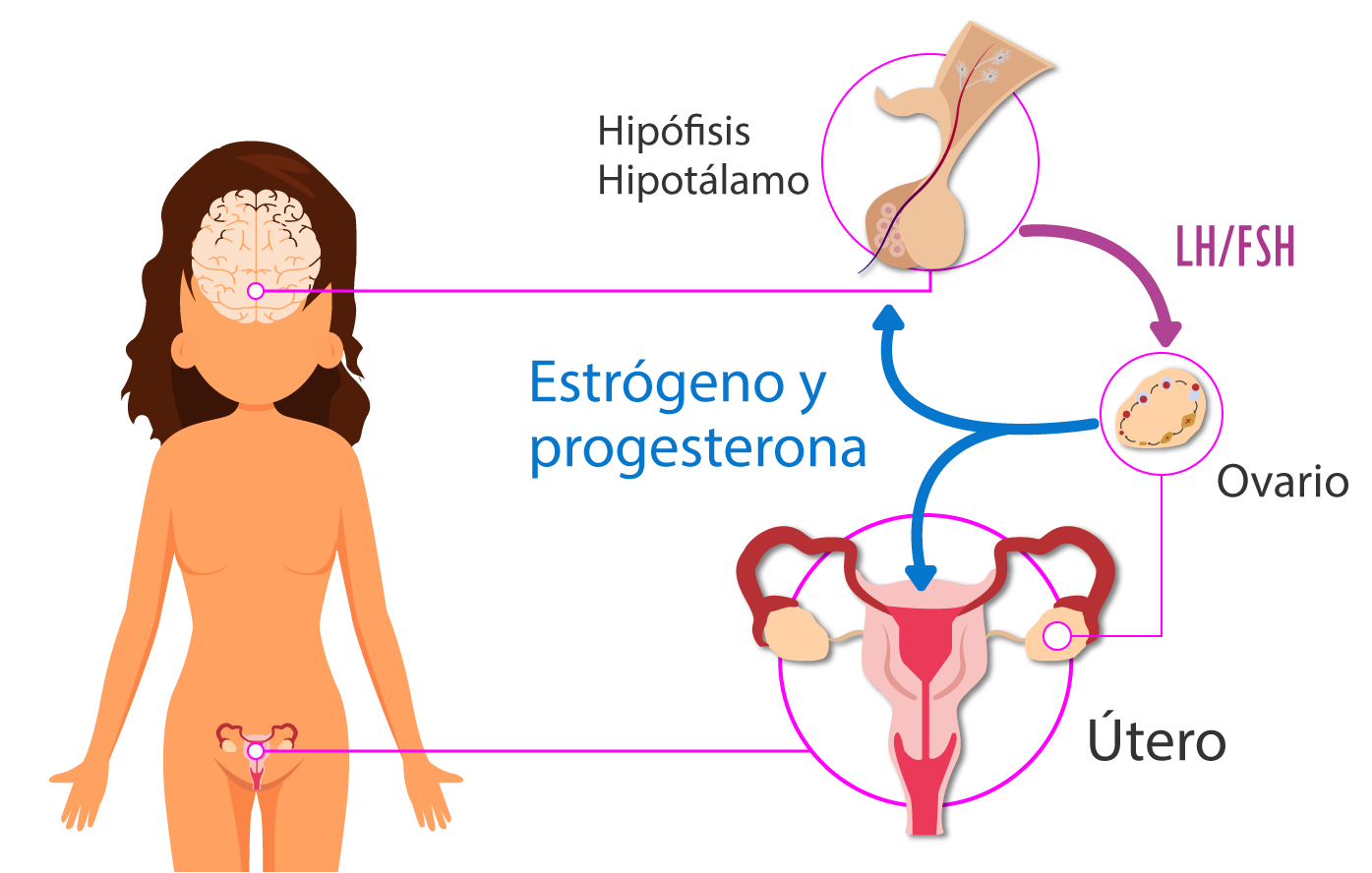
Ciclo sexual femenino
Además, revisaremos que el incremento de la temperatura basal y la secreción cervical son monitores corporales que evidencian que ha ocurrido la ovulación; sin embargo, carecen de valor predictivo.
Finalmente, veremos la ventana de fertilidad, la cual se trata de seis días en los cuales hay una
mayor probabilidad de que la mujer quede embarazada.
Este tema es de gran interés y estudio en la medicina. El aplicar dicho conocimiento te permitirá como
médico determinar si una mujer está en estado fértil o, por el contrario, si existe la presencia de
alguna patología que interfiera con la funcionalidad del ciclo. Además, es un tema necesario para
entender la forma en la que actúan los anticonceptivos hormonales.
¡Esperamos que disfrutes de esta unidad de apoyo para el aprendizaje!
Describir la interacción de las glándulas que forman el eje hipotálamo-hipófisis-ovario, con el fin de relacionarlo con la capacidad reproductiva femenina.
El progreso de la pubertad en las niñas se caracteriza por el inicio de la primera menstruación, la menarca, e indica el comienzo de la capacidad reproductiva. La menstruación es el reflejo del establecimiento del ciclo sexual. La nutrición es un factor determinante para que ocurra la menarca, ya que se requiere de un cierto porcentaje de grasa corporal para que ocurra la madurez sexual (Moschos et ál., 2002). El decaimiento de la reserva folicular del ovario interrumpe la continuidad del ciclo sexual. Una mujer alcanza la menopausia al transcurrir 12 meses sin menstruar (sin usar anticonceptivos hormonales) (Peacock y Ketvertis, 2020, p. 1).
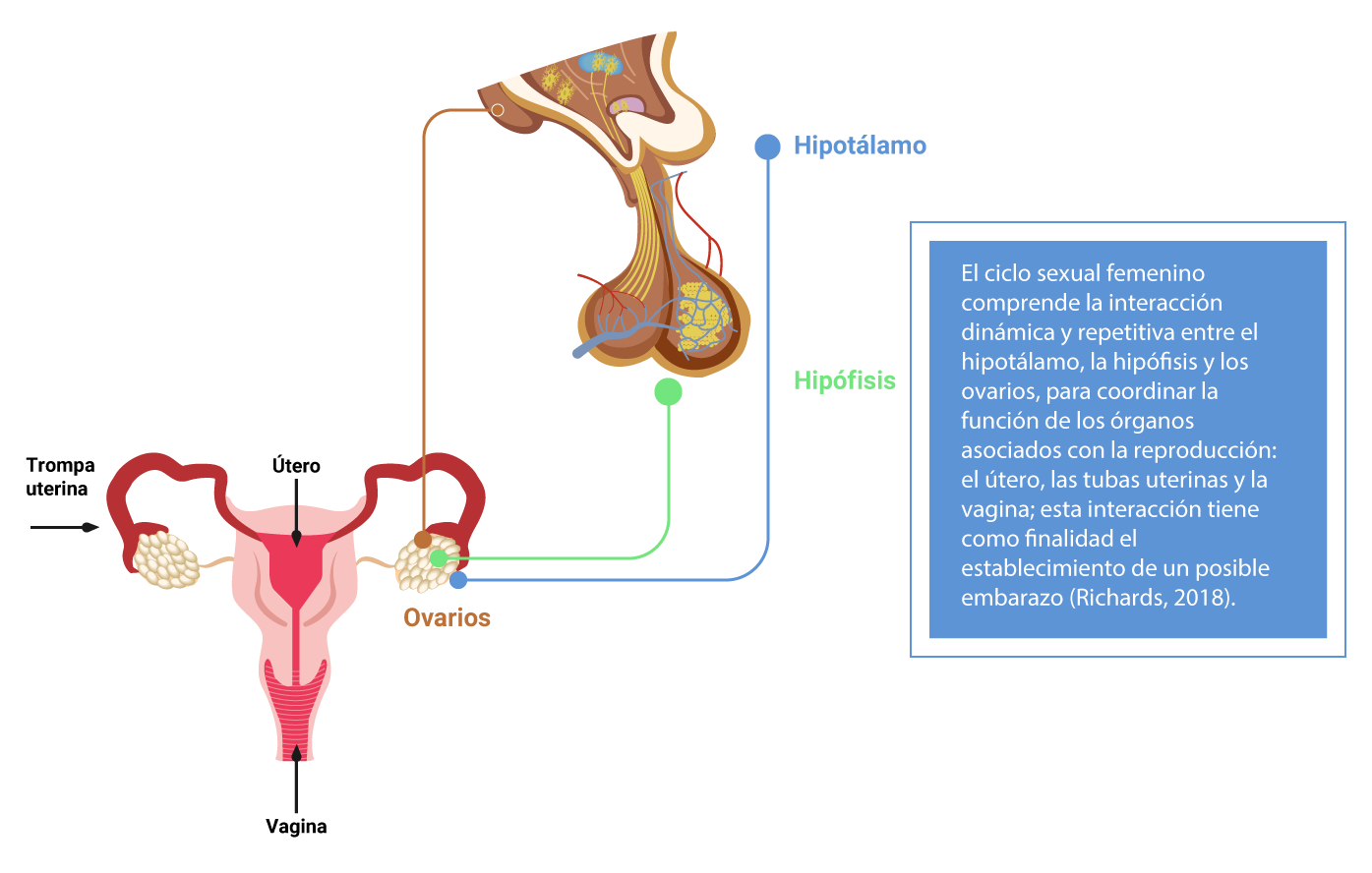
Interacción entre el hipotálamo, la hipófisis y los ovarios
Tanto al principio como al final de la vida reproductiva, el eje hipotálamo-hipófisis-ovario no se encuentra completamente sincronizado, lo que lleva a ciclos con una duración variable y carentes de ovulación.
El control hormonal del ciclo sexual comienza en las neuronas del núcleo arqueado y del área preóptica del hipotalámico con la producción de la hormona liberadora de gonadotropinas (GnRH), la cual es liberada de forma pulsátil hacia la eminencia media, y continúa su viaje a través del sistema porta-hipofisiario (Abreu y Kaiser, 2016). Se une a su receptor ubicado en los gonadótropos de la adenohipófisis, lo que conduce a la estimulación y secreción de las gonadotropinas: la hormona folículo estimulante (FSH) y la hormona luteinizante (LH). La secreción de gonadotropinas permite el crecimiento folicular, la ovulación y la formación del cuerpo lúteo (Reed y Carr, 2018).
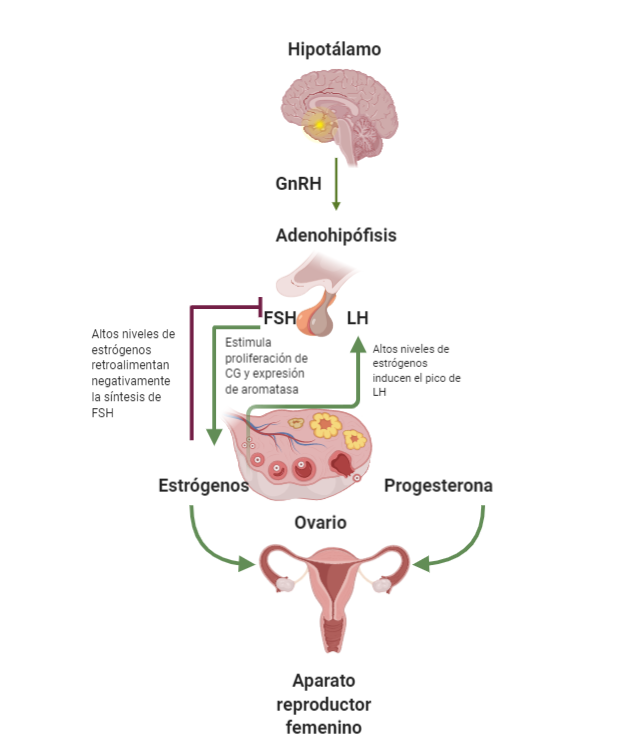
Elaboración propia, con base en Carlson. (2019). Descripción gráfica del eje
hipotálamo-hipófisis-ovario [esquema].
El ovario tiene una función dual, la maduración de ovocitos viables para la fertilización y la
síntesis de las hormonas esteroides (estrógenos y progesterona). Estas dos hormonas
varían en concentración dependiendo del crecimiento folicular (Edson et ál., 2009).
A continuación, encontrarás la descripción de las fases del ciclo ovárico, el cual conlleva el
cumplimiento de ambas funciones:
Esta fase se caracteriza por el crecimiento folicular. Los folículos primordiales se liberan del
estado quiescente a través de factores intraováricos, y su transición hacia folículos primarios es
independiente de gonadotropinas (Edson et ál., 2009). Durante la fase folicular, los niveles de FSH y
LH se incrementan y promueven el reclutamiento de varios folículos secundarios. De esta manera,
se establece un eje de retroalimentación positiva con el ovario, donde la FSH promueve el crecimiento
de los folículos secundarios (ver figura Descripción gráfica del eje hipotálamo-hipófisis-ovario). La
hormona FSH regula la función de las células de la granulosa al unirse al receptor de FSH, lo que
incrementa la proliferación de estas células y la inducción de la expresión de la enzima aromatasa
(Carlson, 2019; Richards, 2018). Las células de la teca, de los folículos en crecimiento, presentan
receptores a la LH, que, al unirse a la LH, promueven la síntesis de andrógenos, los cuáles pasan a
las células de la granulosa y, por acción de la enzima aromatasa, son transformados a
estrógenos. El incremento de estrógenos en los folículos promueve su sensibilización a FSH.
En la siguiente imagen se muestra la síntesis de testosterona y estradiol por parte de las células de
la teca interna y células de la granulosa, respectivamente, por acción de LH y FSH de los folículos
reclutados (Carlson, 2019).
De todos los folículos en crecimiento, se selecciona al folículo dominante, por lo general un
folículo que tiene un mayor número de células de la granulosa y, por lo tanto, un mayor número de receptores
a FSH, lo que lo hace más sensible a esta hormona (Fauser y Van Heusden, 1997). El folículo dominante
aumenta considerablemente de tamaño por aumento de las células de la granulosa; además, incrementa la
cantidad de licor folicular en el antro y la expresión de receptores a LH, ahora en las células de la
granulosa. Estas células se encargarán de producir la mayor cantidad de estradiol en la mitad de la fase
proliferativa. En este momento, el estradiol producido por el folículo dominante regula una
retroalimentación negativa sobre la síntesis de FSH en la adenohipófisis (Baerwald et ál., 2012) (ver figura
de Descripción gráfica del eje hipotálamo-hipófisis-ovario y figura de Folículo dominante).
El folículo dominante produce cerca del 95% de estrógenos en el periodo preovulatorio (Baird y Fraser,
1974). En tanto que los folículos subordinados comienzan a sufrir atresia por decremento de FSH. A su vez,
el folículo dominante produce inhibina (Baerwald et ál., 2012).
En el siguiente esquema se observa la adquisición de receptores a la LH, tanto en las células de la teca
como de la granulosa del folículo dominante (Carlson, 2019).
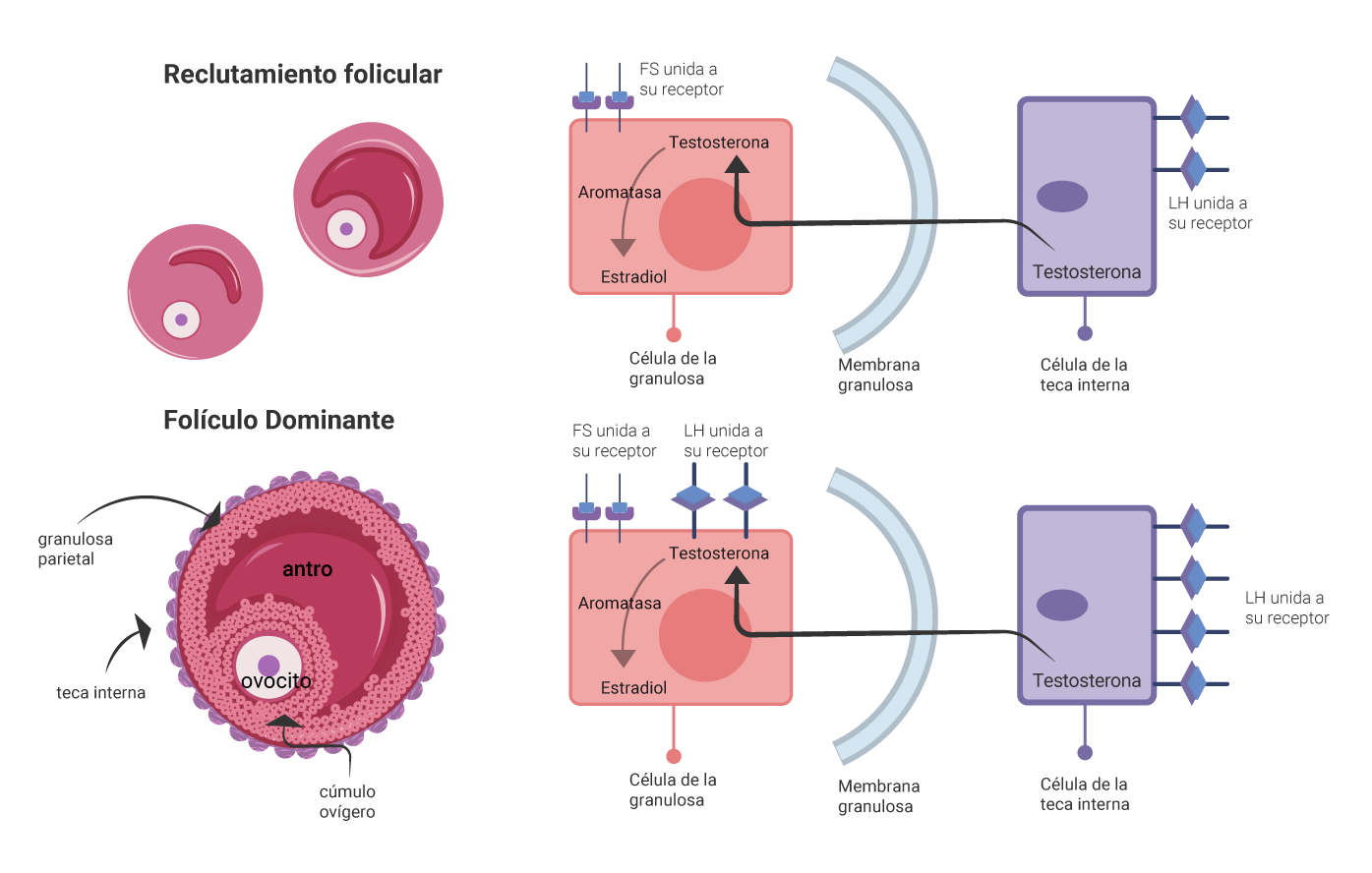
Elaboración propia, con base en Carlson. (2019). Folículo dominante [esquema].
Además de las hormonas esteroides producidas por el ovario, participan factores de señalización
pertenecientes a la superfamilia del factor de crecimiento transformante (TGF-β), tales como la inhibina,
activina y folistatina. La activina es producida por las células de la granulosa y por la adenohipófisis, y
se encarga de estimular la producción de FSH. La folistatina se expresa en la adenohipófisis y en las
células de la granulosa, y es capaz de unirse a la activina e inactivar su función. Finalmente, la inhibina
es producida por las células de la granulosa, y se encarga de decrementar los niveles de FSH, lo que
contribuye seleccionando al folículo dominante (Baerwald et ál., 2012).
Después de la fase folicular, las siguientes fases del ciclo ovárico son la ovulación y la
fase lútea:
Ahora revisaremos cuáles son los efectos de las hormonas esteroides ováricas sobre la función de las tubas uterinas, el útero y el cérvix. Todos estos cambios están enfocados en el transporte del ovocito y del embrión, así como la implantación y el embarazo (Richards, 2018).
La menstruación es el signo evidente que tiene la mujer para dar seguimiento al ciclo sexual; sin embargo, la menstruación es una de las fases del ciclo endometrial. La duración del ciclo menstrual es el número de días entre el primer día de sangrado menstrual hasta el inicio de la menstruación del siguiente ciclo. La duración media del ciclo menstrual es de 28 días, pero la mayoría dura entre 25 y 30 días (Reed y Carr, 2018). Antes de comenzar con la descripción del ciclo endometrial, debemos saber que el útero es un órgano hueco piriforme, cuya pared está conformada con tres capas histológicas:
En la siguiente animación revisaremos los cambios que ocurren en el endometrio por efecto de los estrógenos y la progesterona. Cada cambio será revisado como fases del ciclo endometrial.
Fases del ciclo endometrial
En el siguiente esquema podemos ver los eventos hormonales e histológicos del ciclo sexual.
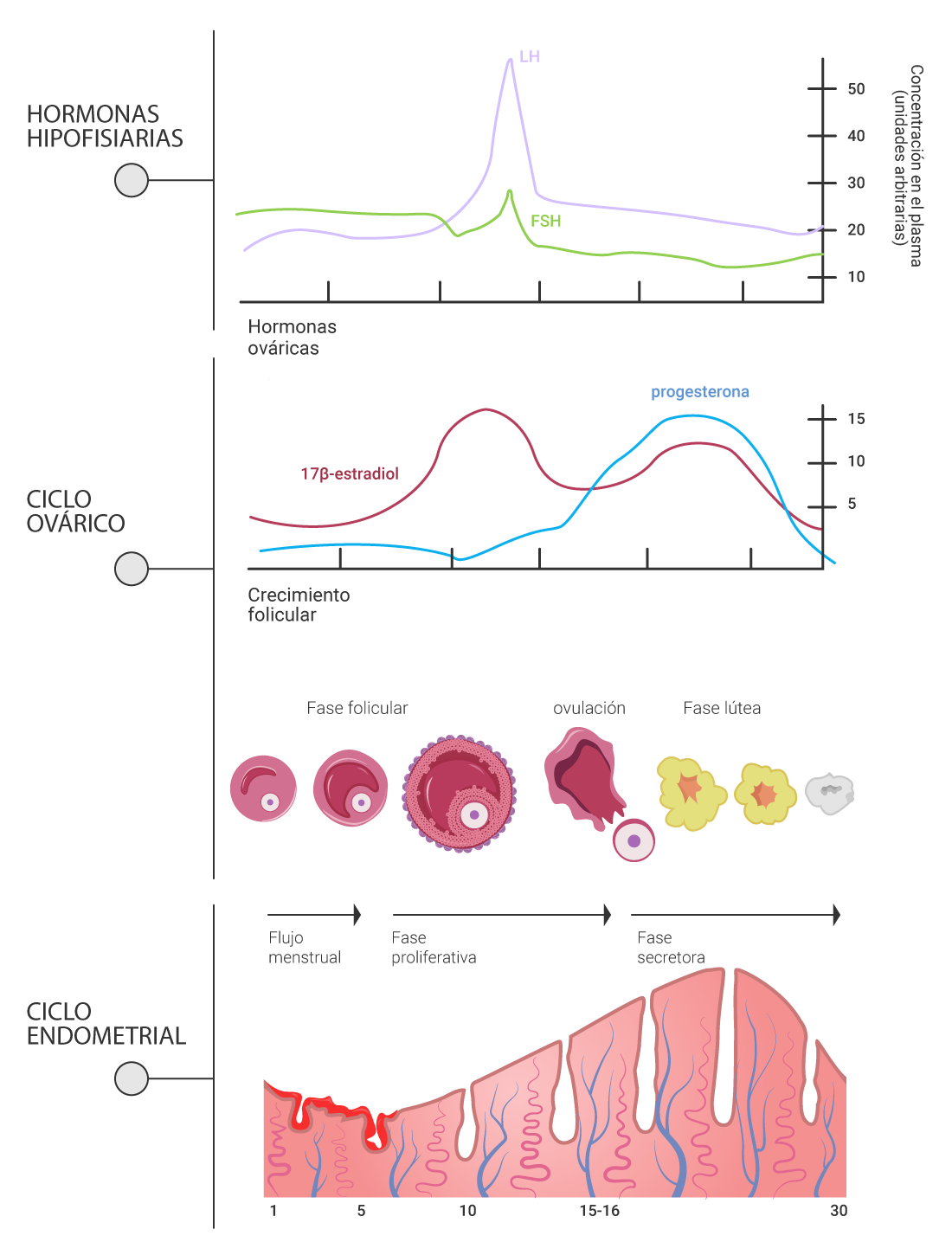
Elaboración propia, con base en Rodríguez y Curell. (2017). Representación esquemática de los
eventos hormonales e histológicos del ciclo sexual [esquema].
En esta sección, se describen los cambios que ocurren en la tuba uterina por influencia de las
hormonas ováricas.
Antes de comenzar, revisemos que la tuba uterina cuenta con tres segmentos anatómicos: el infundíbulo,
la ampolla y el istmo; dichas estructuras se pueden identificar en la siguiente imagen.
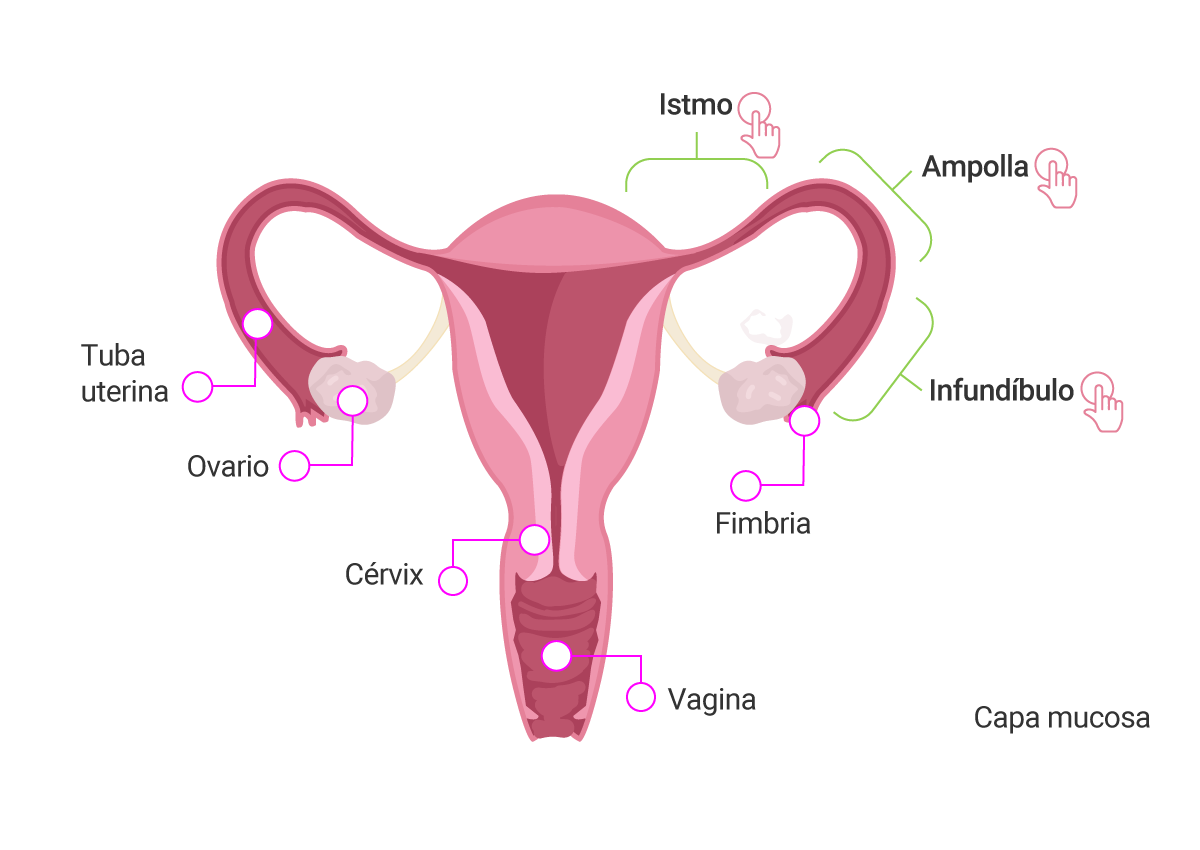
Elaboración propia, con base en Ross y Pawlina. (2016). Segmentos anatómicos del útero y trompas
uterinas [esquema].
La pared de la tuba uterina está compuesta por una externa, una intermedia y una interna (Ross y Pawlina, 2016).
El tipo de epitelio de la capa mucosa es cilíndrico simple, las cuales se clasifican en dos tipos de
células: ciliadas y secretoras. Éstas se muestran en la siguiente figura:
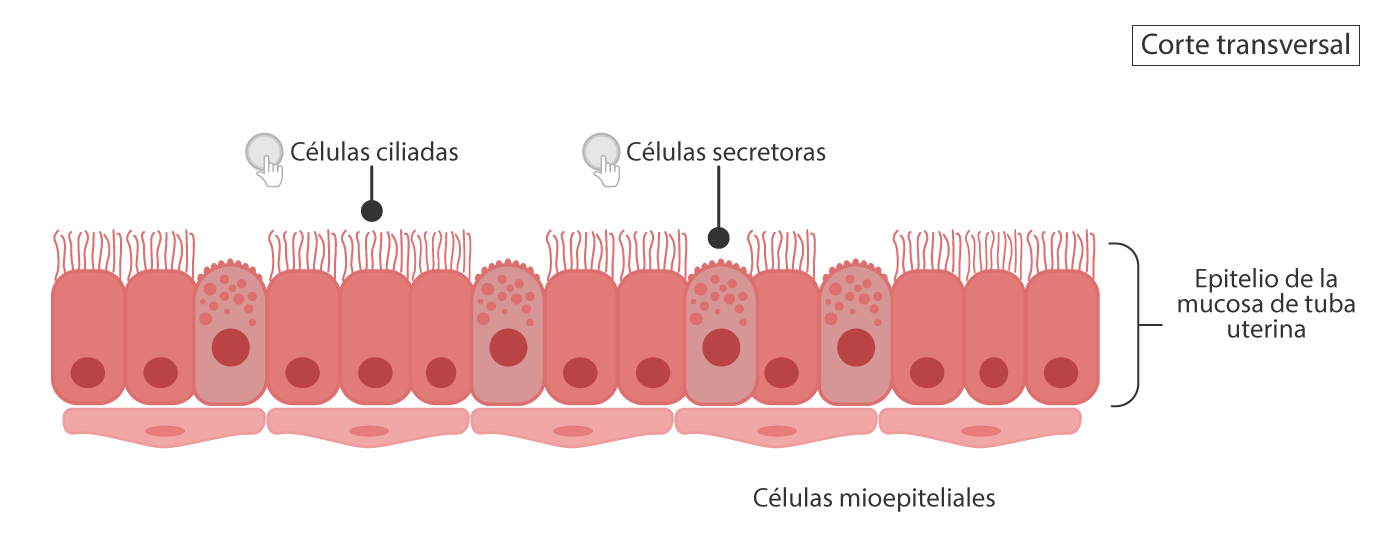
Elaboración propia, con base en Ross y Pawlina. (2016). Caricatura donde se muestran los tipos de
celulares presentes en mucosa de tuba uterina [figura].
Los estrógenos inducen la hipertrofia de las células epiteliales, la actividad ciliar y el aumento de
contractilidad muscular en la tuba uterina, generando movimientos peristálticos que permitirán el transporte
del ovocito (Ross y Pawlina, 2016). Poco antes de la ovulación, hay presencia de líquido tubárico, el cual
es una mezcla de las secreciones de las células epiteliales y el trasudado de capilares. En el momento de la
ovulación, las fimbrias se aproximan al ovario y barren rítmicamente su superficie (Carlson, 2019).
Los niveles elevados de progesterona inducen atrofia de algunas células ciliadas en el epitelio de la tuba
uterina. La relación entre las células ciliadas y secretoras es dependiente de las concentraciones
hormonales durante el ciclo sexual. Los estrógenos estimulan la hipertrofia e hiperplasia de células
ciliadas, mientras que la progesterona favorece la hiperplasia de células secretoras. Durante la ovulación,
el epitelio tubárico presenta una altura de 30 µm aproximadamente; sin embargo, antes del sangrado menstrual
se reduce a la mitad (Ross y Pawlina, 2016).
En esta sección, se describen características importantes del cérvix, así como los cambios que se presentan durante el ciclo sexual. El cérvix actúa como una barrera que restringe la accesibilidad del útero a diversos agentes (Knudtson y McLaughlin, 2019). Además, se subdivide en la porción inferior (ectocérvix) y porción superior (endocérvix) (Kumar et ál., 2015).
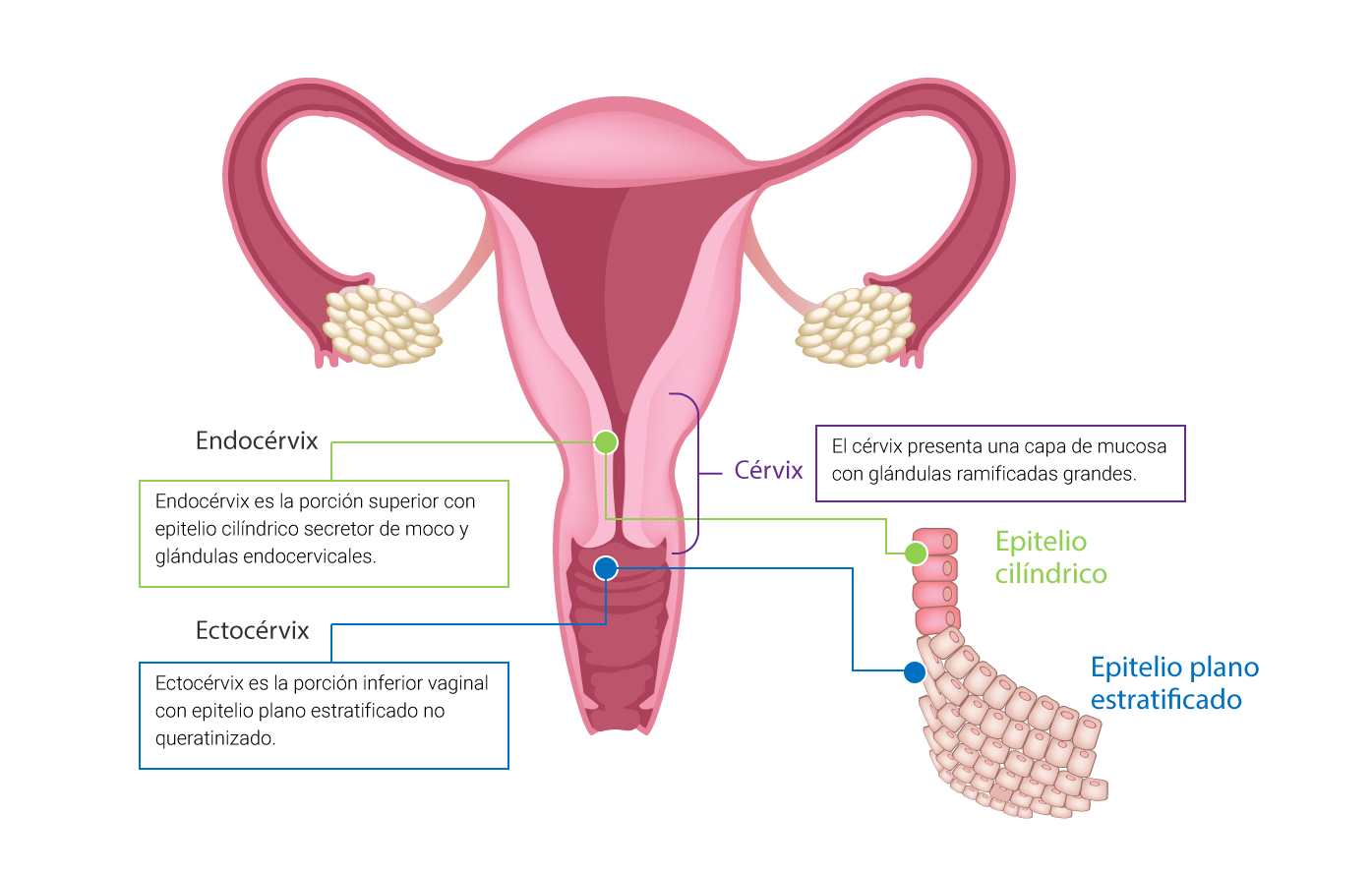
Elaboración propia, con base en Kumar et ál. (2015). Subdivisiones de la porción vaginal
[esquema].
La mucosa cervical tiene cambios en espesor durante el ciclo sexual. Asimismo, las glándulas cervicales
tienen cambios funcionales en el conducto cervical (Ross y Pawlina, 2016).
A continuación, se muestra los cambios que presenta el cérvix durante el ciclo sexual.
Durante la fase estrogénica, se incrementa la vascularización y edema cervical; además, el orificio
cervical se dilata y se llena de moco en el momento de la ovulación (Knudtson y McLaughlin, 2019).
Las glándulas del cérvix secretan un moco rico en glucoproteínas, sales y gran contenido de agua,
lo que le confiere la característica filante; es decir, se forman filamentos de moco que se alinean
a lo largo del endocérvix y, con ello, canales que facilitan el paso de espermatozoides a través
del cérvix. Este moco es también denominado Moco E, y se encuentra presente entre los días 9
y 16 del ciclo (Guyton y Hall, 2011; Thiyagarajan et ál., 2019).
La filancia o capacidad elástica del moco es dependiente de la cantidad de estrógenos. Esta
característica se puede utilizar para identificar la fase periovulatoria o fértil del ciclo sexual
femenino (Knudtson y McLaughlin, 2019).
Durante la etapa progestacional, el moco cervical se vuelve muy viscoso y rico en
glucoproteínas; también es conocido como moco G, y bloquea el paso de espermatozoides al
interior del útero (Carlson, 2019).
Si realizamos un examen microscópico del moco cervical secado sobre un portaobjetos cerca del
periodo de la ovulación, se puede observar la arborización en hojas de helecho, esto debido al
aumento de las sales en el moco cervical y de estrógenos (ver figura Examen microscópico de moco
cervical). Por el contrario, en la fase progestacional, la arborización es mínima o ausente
(Knudtson y McLaughlin, 2019).
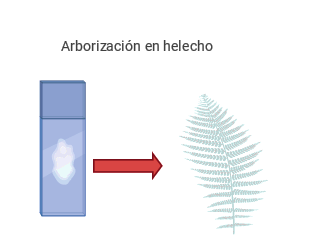
Elaboración propia, con base en la Organización Mundial de la Salud. (2005). Examen
microscópico de moco cervical [ilustración].
Durante la fase folicular, la temperatura corporal varía entre los 36.1 y 36.6 °C; una vez que ocurre la ovulación, la progesterona ejerce un efecto termogénico, incrementando la temperatura corporal cerca de 0.4 °C (Su et ál., 2017; Lei et ál., 2019).

Temperatura coporal
La ventana de fertilidad es el periodo en el cual existe una mayor probabilidad de que ocurra un embarazo.

Ventana de fertilidad en las mujeres
En conclusión, sólo un 30% de las mujeres presentaron una ventana fértil entre el día 10 y 17 de su
ciclo menstrual (Wilcox et ál., 2000). Sin embargo, el momento en el que ocurre la ventana fértil se
vuelve menos predecible para mujeres con ciclos menos regulares (Wilcox et ál., 2000).
Cuando el coito se realiza durante los días fértiles, sólo existe una probabilidad del 50% para que
ocurra la fertilización. Es más probable que ocurra un embarazo si se tienen relaciones sexuales dos
días previos a la ovulación. En el caso de relaciones sexuales que se llevan a cabo cinco días previos
a la ovulación o un día posterior, no conllevan a un embarazo (Wilcox et ál., 2000).
La comunicación entre el sistema nervioso central (hipotálamo e hipófisis) y el ovario se da a
través de la producción de hormonas proteicas y esteroides sexuales. Esta interacción le permite al
ovario cumplir con la formación de ovocitos y hormonas esteroides sexuales necesarias para lograr y
mantener un embarazo.
Sabemos que es mucha la información que ahora debes asimilar, por lo que queremos ayudarte con este
ejercicio de aprendizaje.
El balance hormonal de los esteroides sexuales permite modificar de forma cíclica las características histológicas y funcionales del aparato reproductor femenino. Estos cambios permiten que la mujer presente días en los cuales hay una mayor probabilidad de embarazarse.
El ciclo sexual femenino es la serie de interacciones hormonales entre el hipotálamo, la hipófisis
y el ovario, con la finalidad de preparar un ovocito fertilizable y dar las condiciones idóneas
para establecer un embarazo. En caso de que esto no ocurra, el cuerpo lúteo degenera, por lo que la
producción de progesterona decrementa y ocurre la menstruación, marcando el inicio de un nuevo
ciclo sexual femenino.
Veamos si ya dominas los componentes de la interacción del ciclo sexual femenino.
Básicas
Bibliografía
Carlson, B. (2019). Embriología humana y biología del desarrollo. Barcelona: Elsevier.
Guyton, A. y Hall, J. (2011). Tratado de fisiología médica. Barcelona: Elsevier.
Kumar, R., Abbas, A., Fausto, N. y Aster, J. (2015). Robbins y Cotran. Patología Estructural y
Funcional. Barcelona: Elsevier.
Moore, K., Persaud, T. y Torchia, M. (2016). Antes de nacer. Madrid: Editorial Médica
Panamerica.
Peacock, K. y Ketvertis, K. (2020). Menopause. StatPearls. Florida: StatPearls Publishing.
Rodríguez, M. y Curell, N. (2017). El ciclo menstrual y sus alteraciones. Pediatría Integral,
XXI(5), pp. 304-311.
Ross, M. y Pawlina, W. (2016). Histología, Texto y Atlas. Correlación con biología celular y
molecular. Madrid: Wolters Kluwer.
Documentos electrónicos
Abreu, A. y Kaiser, U. (2016). Pubertal development and regulation. The lancet. Diabetes &
Endocrinology, 4(3), 254-264. Consultado de http://doi.org/10.1016/S2213-8587 (15)00418-0
Baerwald, A., Adams, G. y Pierson, R. (2012). Ovarian antral folliculogenesis during the human
menstrual cycle: a review. Human reproduction update, 18(1), 73-91. Consultado de
http://doi.org/10.1093/humupd/dmr039
Baird, D. y Fraser, I. (1974). Blood production and ovarian secretion rates of estradiol-17 beta and
estrone in women throughout the menstrual cycle. The Journal of Clinical Endocrinology and
Metabolism, 38(6), 1009-1017. Consultado de http://doi.org/10.1210/jcem-38-6-1009
Edson, M., Nagaraja, A. y Matzuk, M. (2009). The mammalian ovary from genesis to revelation.
Endocrine Reviews, 30(6), 624-712. Consultado de http://doi.org/10.1210/er.2009-0012
Fauser, B. y Van Heusden, A. (1997). Manipulation of human ovarian function: physiological concepts
and clinical consequences. Endocrine Reviews, 18(1), 71-106. Consultado de
http://doi.org/10.1210/edrv.18.1.0290
Lei, T., Cotter, J., Schlader, Z., Stannard, S., Perry, B., Barnes, M. et ál. (2019). On exercise
thermoregulation in females: interaction of endogenous and exogenous ovarian hormones. The Journal
of Physiology, 597(1), 71-88. Consultado de http://doi.org/10.1113/JP276233
Moschos, S., Chan, J. y Mantzoros, C. (2002). Leptin and reproduction: a review. Fertility and
Sterility, 77(3), 433-444. Consultado de http://doi.org/10.1016/s0015-0282 (01)03010-2
Reed, B. y Carr, B. (2018). The normal menstrual cycle and the control of ovulation. Endotext.
Massachussets: MDText.com, Inc. Consultado el 10 de julio de 2020 de
https://www.ncbi.nlm.nih.gov/books/NBK279054/?report=reader
Richards, J. (2018). The ovarian cycle. Vitamins and Hormones, 107, 1-25. Consultado de
http://doi.org/10.1016/bs.vh.2018.01.009
Su, H., Yi, Y., Wei, T., Chang, T. y Cheng, C. (2017). Detection of ovulation, a review of currently
available methods. Bioengineering & Translational Medicine, 2(3), 238-246. Consultado de
https://doi.org/10.1002/btm2.10058
Thiyagarajan, D., Basit, H. y Jeanmonod, R. (2019). Physiology, menstrual cycle. StatPearls.
Consultado el 10 de julio de 2020 de https://www.statpearls.com/as/gynecologic/24987/
Wilcox, A., Dunson, D. y Baird, D. (2000). The timing of the "fertile window" in the menstrual cycle:
day specific estimates from a prospective study. British Medical Journal, 321(7271), 1259-1262.
Consultado de http://www.bmj.com/content/321/7271/1259/rapid-responses
Sitios electrónicos
Knudtson, J. y McLaughlin, J. (2019). Endocrinología reproductiva femenina. Manual MSD, Versión
para profesionales. Consultado el 10 de julio de 2020 de
https://www.msdmanuals.com/es-mx/professional/ginecolog%C3%ADa-y-obstetricia/endocrinolog%C3%ADa-reproductiva-femenina/endocrinolog%C3%ADa-reproductiva-femenina
Cómo citar
Díaz, V. y Saavedra, M. (2021). Ciclo sexual femenino. Unidades de Apoyo para el Aprendizaje. CUAIEED/Facultad de Medicina-UNAM. (Vínculo)