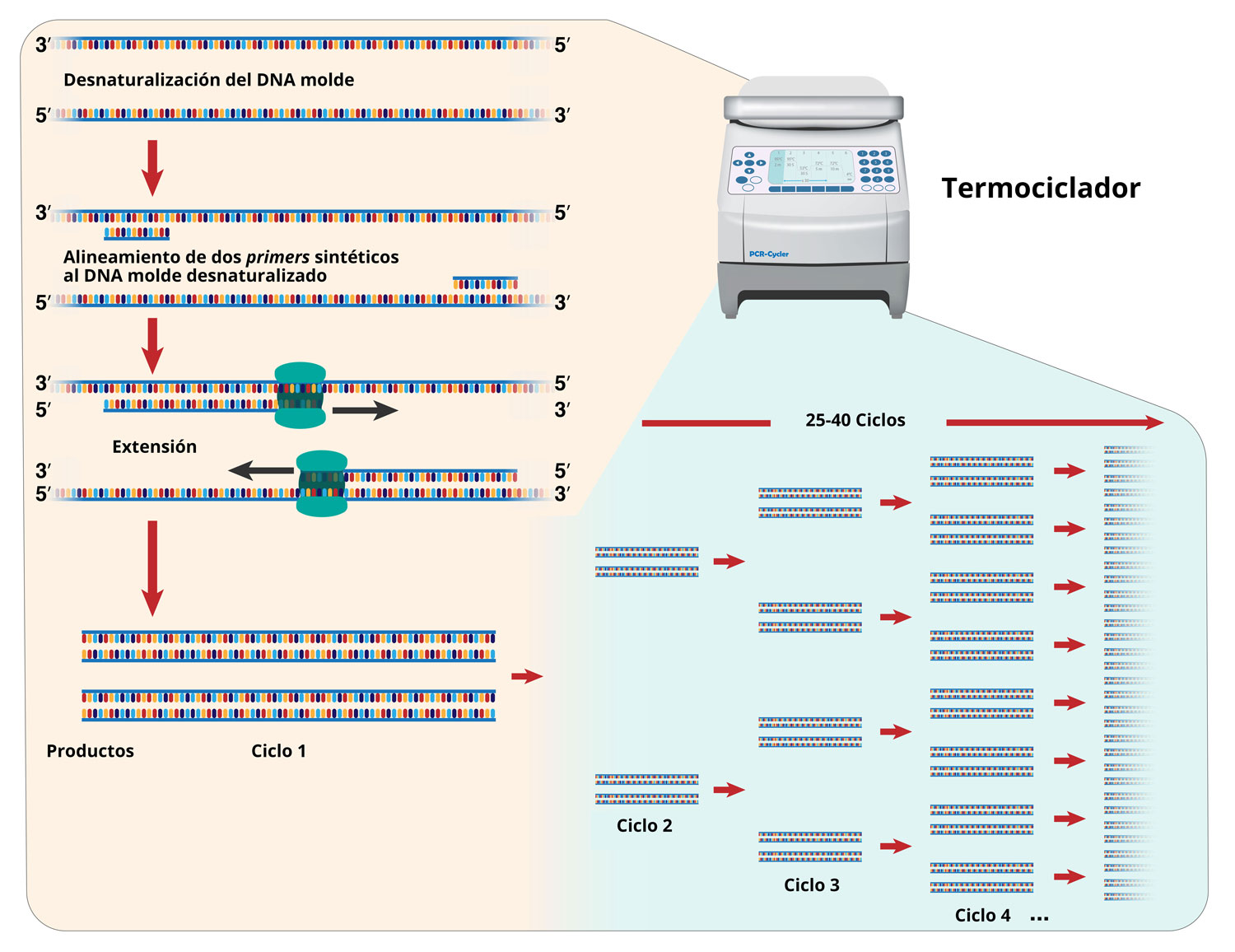
Cañavate, C., Cuadros, J., Martínez, R. y Martín, P. (2009). Procedimientos en microbiología clínica. El laboratorio de microbiología ante las enfermedades parasitarias importadas. EIMC.
Conn, P. M. (2012). Laboratory Methods in Cell Biology (vol. 112) (pp. 55-68). Academic Press.
Green, M. R. & Sambrook, J. (2019). Polymerase chain reaction. Cold Spring Harbor Protocols, 6, pdb-top095109.
Kuslich, C., Chui, B. & Yamashiro, T. (2019). Overview of PCR. Current Protocols Essential Laboratory Techniques, 18, e27. doi: 10.1002/cpet.27
Markoulatos, P., Siafakas, N. & Noncany, M. (2002). Multiplex polymerase chain reaction: A practical approach. Journal of Clinical Laboratory Analysis, 16, 47-51.
Méndez, A. S. y Pérez, R. E. (2004). La PCR múltiple en microbiología clínica. Enferm Infecc Microbiol Clin, 22(3),183-192.
Olofsson, S., Brittain, L. R., Andersson, L. M., Westin, J. & Lindh, M. (2011). PCR for detection of respiratory viruses: Seasonal variations of virus infections. Expert Rev Anti Infect Ther, 9(8), 615-626.
Rajalakshmi, S. (2017). Different types of PCR techniques and its applications. International Journal of Pharmaceutical, Chemical and Biological Sciences, 7(3), 285-292.
Reineke, J. (2012). Nanotoxicity. Methods and Protocols (pp.99-104). Humana Press.
Rodríguez, G., Acono, M. y Zarain, A. (2021). Reacción en cadena de la polimerasa en tiempo real. Mensaje Bioquímico, 45, 11-22.
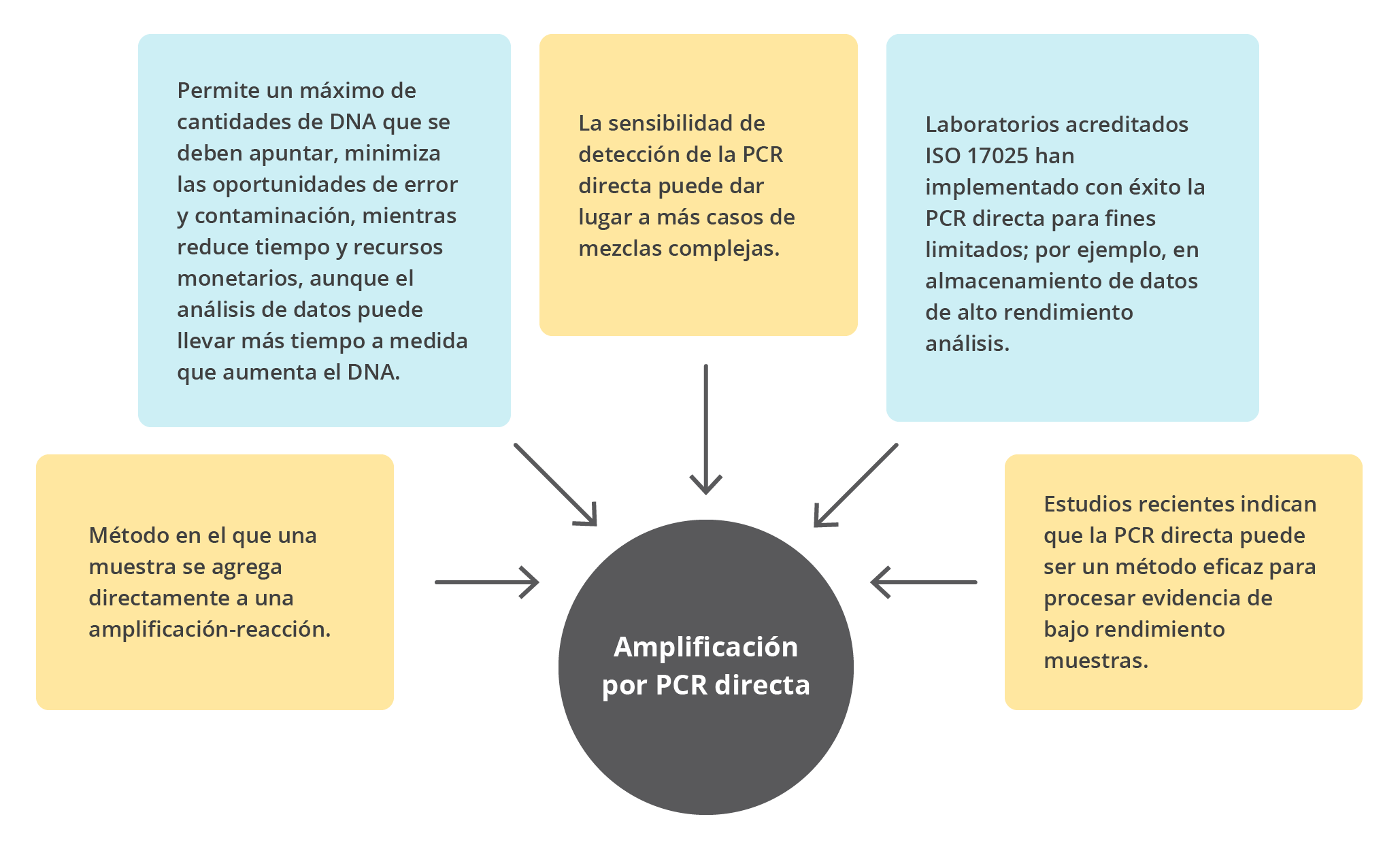
Sarah, E. & Cavanaugh, S. B. (2018). Direct PCR amplification of forensic touch and other challenging DNA samples: A review. Forensic Science International: Genetics, 32, 40-49.
Sueoka, K. (2015). Preimplantation genetic diagnosis: An update on current technologies and ethical considerations. Reprod Med Biol, 15(2), 69-75. doi:10.1007/s12522-015-0224-6
Valero, C., De la Cruz, L., Zaragoza, O. & Buitrago, M. J. (2016). New panfungal real-time PCR assay for diagnosis of invasive fungal infections. Journal of Clinical Microbiology, 54, 2910–2918. doi:10.1128/JCM.01580-16
Walker, J. M. & Rapley, R. (2008). Molecular biomethods handbook (2.ª ed.). Humana Press.
Watzinger, F., Ebner, K. & Lion, T. (2006). Detection and monitoring of virus infections by real-time PCR. Mol Aspects Med, 27(2), 254-298.
Camunas, J., Lee, H., Hudgins, L., Hintz, S. R., Blumenfeld, Y. J., El-Sayed, Y. & Quake, S. R. (2018). Noninvasive prenatal diagnosis of single-gene disorders by use of droplet digital PCR. Clinical Chemistry, 64(2), 336–345, https://doi.org/10.1373/clinchem.2017.278101
Huang, H., Zhou, T., Zhang, J., Yao, W. & Zhang, G. (2019). Prenatal diagnosis of genetic diseases directly using paper-dried cord blood as the starting material for PCR. Anal Bioanal Chem, 411, 6825-6835. https://doi.org/10.1007/s00216-019-02048-x
Lorenz, T. C. (2012). Polymerase chain reaction: Basic protocol plus troubleshooting and optimization strategies. Journal of Visualized Experiments: JoVE, 63, e3998. https://doi.org/10.3791/3998
Mackay, I. M., Arden, K. E. & Nitsche, A. (2002). Real-time PCR in virology. Nucleic Acids Research, 30(6), 1292-1305. https://doi.org/10.1093/nar/30.6.1292
NIH/National Human Genome Research Institute. (2022). Reacción en cadena de la polimerasa (PCR). https://www.genome.gov/es/genetics-glossary/Reaccion-en-cadena-de-la-polimerasa
Pedrosa, A. (1999). Reacción en cadena de la polimerasa. Revista Archivo Médico de Camagüey, 3(2). http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1025-02551999000200011&lng=es&tlng=es
Tamay, L., Ibarra, C. y Velasquillo, C. (2013, mayo-agosto). Fundamentos de la reacción en cadena de la polimerasa (PCR) y de la PCR en tiempo real. Investigación en Discapacidad, 2(2). https://www.academia.edu/16639841/Fundamentos_de_la_reacci%C3%B3n_en_cadena_de_la_polimerasa_PCR_?from=cover_page
Villegas, V. E., Sánchez, M. C. y Chuaire, L. (2009). Reacción en cadena de la polimerasa y diagnóstico molecular. Colombia Médica, 40(3), 347-352. http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S1657-95342009000300011&lng=en&tlng=es
Zhu, H., Zhang, H., Xu, Y., Laššáková, S., Korabečná, M. y Neužil, P. (2020). PCR pasado, presente y futuro. BioTechniques, 69(4), 317-325. https://doi.org/10.2144/btn-2020-0057
González, L., López, R., Domínguez, M. y Gutiérrez, A. (2022). Reacción en cadena de la polimerasa. Unidades de Apoyo para el Aprendizaje. CUAIEED/FES Cuautitlán-UNAM. (Vínculo)